

Orientador(a): Thiago Henrique Annibale Vendramini
Instituição: Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo
Trabalho Classificado na 10ª Edição (2024) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
Os ácidos graxos de cadeia curta exercem funções celulares e metabólicas essenciais no organismo canino. O atual método mais utilizado para quantificar os ácidos graxos consiste na mensuração fecal por cromatografia gasosa. Na medicina humana, está em difusão a mensuração de ácidos graxos em soro, visto que o aumento na concentração de acetato e propionato está associado com a saúde metabólica. Portanto, este estudo buscou avaliar a interrelação entre os métodos de quantificação de ácidos graxos fecais, séricos e metabolômica do soro de cães adultos saudáveis. Foram selecionados oito cães adultos saudáveis, quatro border collie e quatro cocker spaniel, e divididos em dois quadrados latinos 4×4 balanceados. A determinação de ácidos graxos de cadeia curta e ramificada fecais e séricos foi realizada por meio da cromatografia em estado gasoso. A análise de metabolômica foi realizada ressonância magnética nuclear a 300 K, em um espectrômetro AVANCE III HD 600. Os espectros obtidos foram trabalhados nos softwares TopSpin® 3.5, Chenomix® e Mvova®. As análises estatísticas multivariadas foram realizadas no software MetaboAnalyst®. As comparações univariadas entre as médias dos tratamentos e as correlações entre os grupos de variáveis foram realizadas no programa Statistical Analysis System versão 9.4. Não foram apontadas diferenças nas concentrações de ácidos graxos fecais, séricos e metabólitos séricos entre os tratamentos. No entanto, as médias observadas correspondem ao esperado do metabolismo canino. Apesar de não observadas correlações significativas, a análise hierárquica de mapa de calor dos principais metabólitos sugeriu que o colesterol e a L-acetilcarnitina séricos apresentaram alto grau de importância na diferenciação do tratamento 0,14%. Tais achados ressaltam a importância de novas investigações que identifiquem metabólitos de baixo peso molecular e lipídios. Apesar da evidente interdependência biológica entre as variáveis avaliadas, concluiu-se que os métodos propostos resultam em resultados linearmente independentes. Portanto, sugere-se a utilização dos três diferentes métodos em estudos sobre o metabolismo canino.
Palavras-chave: beta-oxidação, caninos, ciências ômicas, metodologia, nutrição.
Introdução
Os ácidos graxos de cadeia curta desempenham importantes funções celulares e metabólicas no organismo animal (Tan et al., 2014). Representam os principais, os ácidos acético, propiônico e butírico (Cummings et al., 1987). A via de produção destes compostos é por meio da microbiota intestinal, responsável por fermentar fibras e proteínas dietéticas (Louis et al., 2007). É teorizada que a distribuição do acetato, propionato e butirato nas fezes de cães é dada pela proporção respectiva de 66:24:10 (Kamath; Hoepfner; Phillips, 1987).
De forma geral, grande parcela dos ácidos graxos de cadeia curta são absorvidos pelos colonócitos (Myhrstad et al. 2020). No entanto, o butirato destaca- se por apresentar alta taxa de aproveitamento e metabolização como fonte de energia para estas células (Walker; Duffy, 1998). As frações restantes de acetato e propionato são transportados para o fígado e metabolizados, ou atingem a circulação sanguínea (Pomare; Brach; Cummings, 1985; Müller, et al. 2019).
Na medicina veterinária, as fezes são a principal amostra utilizada para a detecção dos ácidos graxos de cadeia curta. No entanto, a célere absorção pelos colonócitos e as possíveis interações metabólicas com a microbiota intestinal podem subestimar as concentrações observadas (Swanson et al., 2002). Neste sentido, emerge a possibilidade em mensurar tais compostos no soro. Este é um método novo e disseminado na medicina humana, sustentado por conta da associação direta entre os ácidos acético e propiônico e a saúde metabólica geral (Fristedt et al., 2024). Em estudos com cães e gatos, no entanto, a determinação sérica é muito pouco empregada. A ausência de protocolos padronizados, a volatilidade dos ácidos e a falta de literatura são alguns dos possíveis obstáculos.
Diante do exposto, o estudo da metabolômica pode ser de grande valia para maiores esclarecimentos. Isto pois, o estudo do metaboloma infere a quantificação de um grande número de metabólitos em resposta aos fatores estudados (Lindon; Holmes; Nicholson, 2001), dentre eles os próprios ácidos graxos de cadeia curta. Dada a importância dos ácidos graxos de cadeia curta em cães, uma vez que são fonte de energia para o metabolismo e renovação de colonócitos, exercem efeito anti-inflamatório e influenciam na redução do pH intestinal (Swanson et al., 2002; Adams, 2003; Morrison; Preston, 2016); buscou-se estudar mais a fundo os métodos de quantificação, para responder perguntas como: as avaliações de ácidos graxos de cadeia curta fecais e séricos e os metabólitos do soro de cães adultos estão interrelacionadas? Há relação de dependência entre os resultados?
Material e métodos
O estudo foi conduzido de acordo com as normas da Comissão de Ética no Uso de Animais, sob número de protocolo 2866090223. Quatro cães border collie e quatro cocker spaniel inglês machos e fêmeas, com idade de 3,5±0,5 anos e escore de condição corporal ideal (Laflamme, 1997) foram distribuídos aleatoriamente em dois quadrados latinos 4×4 balanceados. Foram utilizados quatro alimentos experimentais isonutritivos, que variavam apenas com base no teor de beta-glucanos incluso (0,0%; 0,07%; 0,14%; 0,28%).
Os beta-1,3/1,6-glucanos obtidos de Saccharomyces cerevisiae foram escolhidos devido ao alto potencial prebiótico em baixas doses de consumo, o que mitiga variações entre as dietas em teste. A necessidade energética de manutenção dos cães foi determinada por meio da equação 95 kcal × peso corporal0,75 (FEDIAF, 2021). Cada período apresentou duração total de 35 dias, os quais foram divididos em 28 dias para adaptação às dietas e sete dias para a coleta de amostras fecais e sanguíneas. Foram realizadas as determinações de ácidos graxos de cadeia curta e ramificada fecais e séricos e metabolômica sérica de todos os animais.
As determinações de ácidos graxos de cadeia curta e curta ramificada fecais e séricos foram realizadas por cromatografia gasosa (Shimadzu Corporation, Kioto, Japão), de acordo com Erwin et al. (1961) e adaptação de Getachew et al. (2002). Foi utilizado detector de ionização de chama e coluna de separação Stalbilwax® (Restek, EUA) de 30 metros e 0,53mm. O injetor e o detector de chama foram mantidos a 250°C. A temperatura da coluna foi mantida em 145°C.
As análises metabolômicas foram realizadas em ressonância magnética nuclear a 300 K, em um espectrômetro AVANCE III HD 600 (Bruker Corporation, Billerica, Massachusetts, EUA) que observou 1H e 13C. Os espectros foram processados utilizando o software TopSpin 3.5. Todos os deslocamentos químicos de 1H e 13C foram observados em ppm em relação ao sinal de DSS em 0,00 ppm como referência interna, e um alargamento exponencial de linha de 0,3 Hz foi aplicado. Os metabólitos foram atribuídos com base nos deslocamentos químicos e multiplicidades de sinal usando o software Chenomix (Beckonert et al., 2007).
Para o pré-tratamento dos metabólitos, foram calculados buckets retangulares de 0,04 ppm, com uso do software Mvova®. A análise incluiu as regiões entre 0,2 e 10 ppm. Foi excluído o sinal residual da água. Os dados do metaboloma foram carregados no MetaboAnalyst® 5.0 (Chong et al., 2019). De forma prévia às análises estatísticas e bioinformáticas, os dados foram normalizados com base na mediana e escala de Pareto. A análise de componentes principais (PCA) foi realizada e os principais metabólitos na análise de carregamento de cada PCA foram identificados e utilizados para realizar uma análise de cluster hierárquico, que comparou a intensidade dos metabólitos entre os tratamentos.
O modelo estatístico incluiu o efeito fixo de tratamento e os efeitos aleatórios de animal dentro de quadrado, período e resíduo. Foram realizadas análises de correlação momento-produto de Pearson entre os três grupos de variáveis, em vista da avaliação de associações lineares de primeiro grau. As análises foram realizadas com auxílio dos procedimentos MIXED e CORR do programa Statistical Analysis System, versão 9.4 (SAS Institute Inc., Cary, NC, EUA).
Resultados
Não foram observadas diferenças entre as médias observadas nos tratamentos para a concentração de ácidos graxos fecais e séricos (Tabela 1). Ademais, não foram detectados o butirato, isobutirato, valerato e isovalerato nas amostras de soro, visto que apresentam baixa concentração no sangue canino.
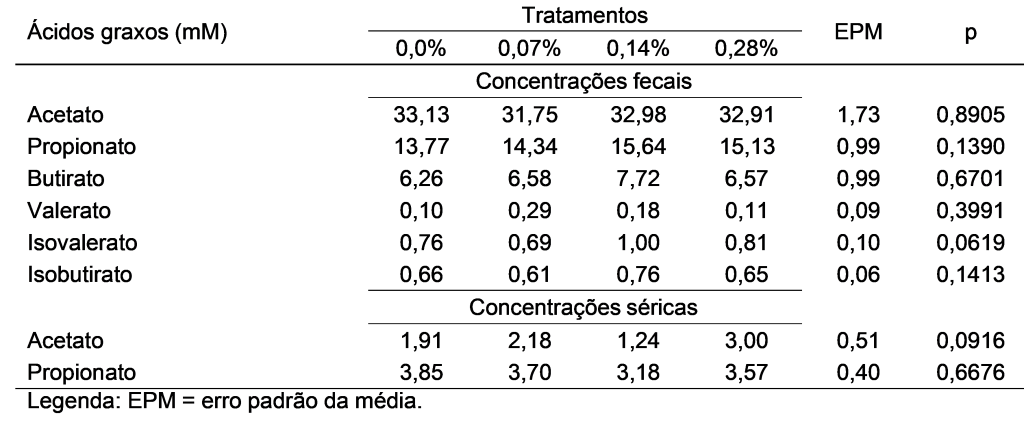
Ademais, não foram observadas diferenças para as abundâncias dos principais metabólitos quantificados (Tabela 2).
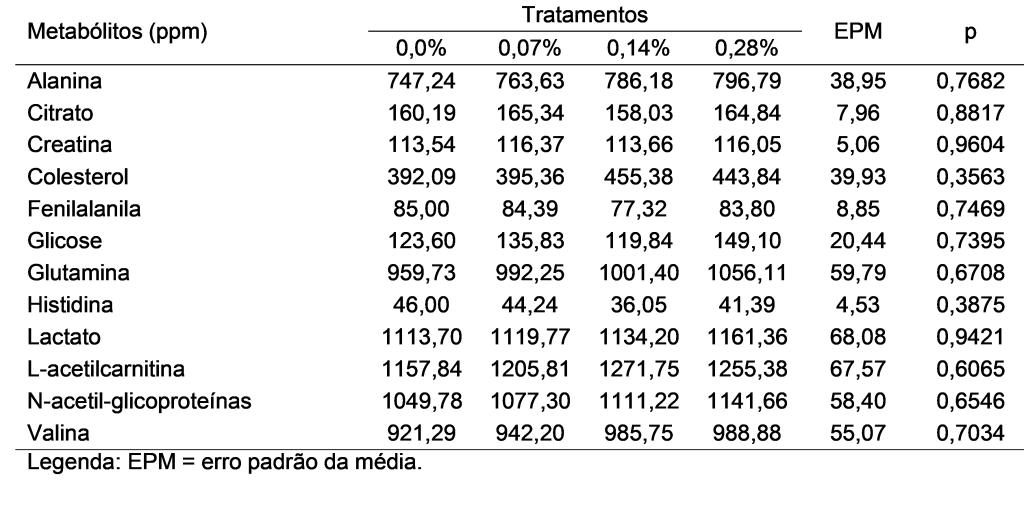
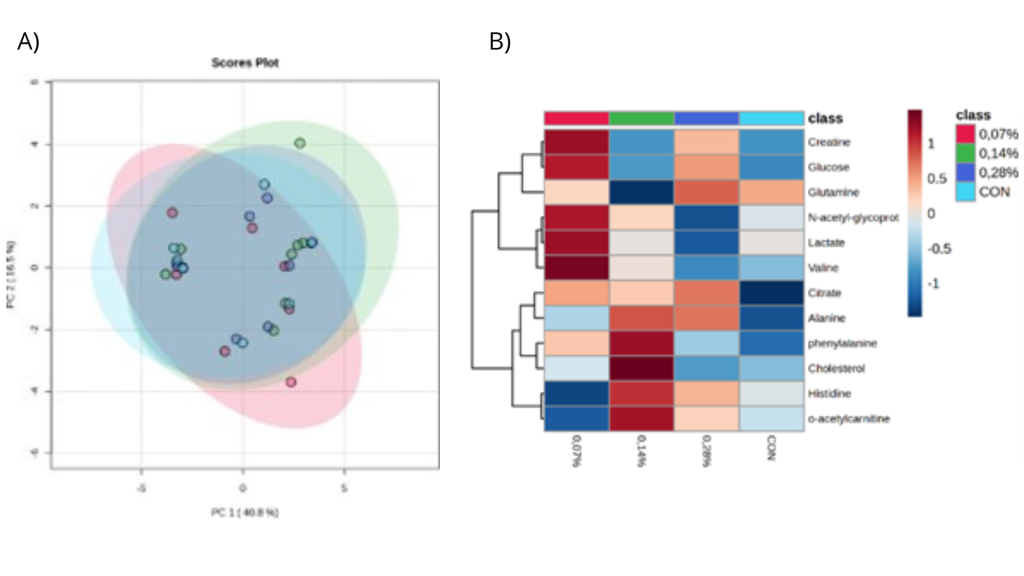
A análise multivariada indicou associações entre doze principais metabólitos. Ademais, a análise foi sugestiva para diferenças metabólicas em quinze diferentes lipídios que não puderam ser identificados. Desta forma, foi realizada uma análise de principais componentes apenas com os compostos identificados, que revelou sobreposições entre os tratamentos (Figura 1A). O componente principal 1 explicou 40,8% da variância dos dados e o componente principal 2 explicou 16,5%. Ademais, um mapa de calor de agrupamento hierárquico (Figura 1B) mostrou diferenças na intensidade dos doze compostos-chave entre os tratamentos.
Por fim, estão descritas as correlações realizadas entre os ácidos graxos de cadeia curta e curta ramificada fecais, os ácidos graxos de cadeia curta séricos e os doze metabólitos-chave identificados (Tabela 3). O coeficiente de correlação de Pearson é representado pela letra r e assume valores de -1 a 1. De acordo com Callegari-Jacques (2009), valores de r entre 0 e 0,3 correspondem a fracas correlações e valores de r entre 0,3 e 0,6, correlações moderadas. No presente ensaio, foram observadas apenas fracas a moderadas correlações lineares.

Discussão
Nas amostras de fezes, foram detectados os principais ácidos graxos de cadeia curta e curta ramificada. De forma geral, as concentrações de acetato, propionato e butirato fecais demonstraram proporção de 61:27:12 semelhante com a proposta por Kamath, Hoepfner e Phillips (1987). Por outro lado, as concentrações séricas são condizentes com o metabolismo dos ácidos graxos no organismo animal. Uma vez que o acetato e propionato podem ser absorvidos pelos colonócitos ou metabolizados no fígado, foram detectados baixos teores no soro dos cães. Neste sentido, a não detecção do butirato é justificada por sua metabolização como fonte energética para os colonócitos. Ademais, a ausência de detecção dos ácidos graxos de cadeia ramificada no soro, se deve à sua excreção fecal em baixa concentração nos intestinos saudáveis (Nery et al., 2012).
Por meio das análises de metabolômica sérica, foram identificados apenas compostos de alto peso molecular. Os resultados observados na comparação univariada dos doze principais metabólitos identificados e as sobreposições caracterizadas na avaliação de principais componentes demonstram que o perfil metabólico entre os grupos pouco diferiu (Carlos; Dos Santos; Fröehlich, 2020). De forma geral, as padronizações no manejo, saúde e dieta dos animais foi proposta para reduzir variações indesejadas nas análises realizadas.
Neste sentido, a análise hierárquica com mapa de calor demonstrou a importância dos metabólitos para a diferenciação dos tratamentos. O colesterol e a L-acetilcarnitina estão fortemente associadas com diferenças no perfil metabólico dos cães do grupo 0,14%. Estes dois metabólitos são de suma importância para a beta-oxidação dos ácidos graxos (Nelson; Cox, 2019). Este achado sugere a necessidade de novas investigações que visem a identificação de metabólitos de baixo peso molecular e lipídios por lipidômica. Desta forma, novas correlações pontuais podem ser sugeridas e melhor estudadas.
Conclusão
Baseado na ausência de associação entre os ácidos graxos de cadeia curta fecais e séricos e os doze metabólitos identificados, conclui-se que os métodos de quantificação destes compostos são linearmente independentes. Portanto, recomenda-se o emprego dos três diferentes métodos em ensaios que visam o estudo do metabolismo intestinal e de beta-oxidação em cães adultos saudáveis.
Referências bibliográficas
ADAMS, C. A. Carbohydrates Nutricines: Non-digestible oligosaccharides. In: Nutricines – Food Components in Health and Nutrition. Nottingham: Nottingham University Press, 2003.
BECKONERT, O. et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nature Protocols, v. 2, p. 2692–2703, 2007.
CALLEGARI-JACQUES, S. M. Bioestatística: princípios e aplicações. Porto Alegre: Artmed Editora, 2009.
CARLOS, G.; DOS SANTOS, F. P., FRÖEHLICH, P. E. Canine metabolomics
advances. Metabolomics: Official journal of the Metabolomic Society, v. 16, p. 16, 2020.
CHONG, J. et al. Using MetaboAnalyst 4.0 for Comprehensive and Integrative Metabolomics Data Analysis. Current Protocols in Bioinformatics, v. 68, p. e86, 2019.
CUMMINGS, J. H.et al. Short chain fatty acids in human large intestine, portal, hepatic and venous blood. Gut, v. 28, p. 1221–1227, 1987.
ERWIN, E. S. et al. Volatile fatty acid analyses of blood and rumen fluid by gas chromatography. Journal of Dairy Science, v. 44, p. 1768–1771, 1961.
FEDIAF. The European Pet Food Industry Federation. Nutritional guidelines for complete and complementary pet food for cats and dogs. Bruxelas, BE: The European Pet Food Industry Federation, 2020.
FRISTEDT, R. et al. Quantitation of circulating short-chain fatty acids in small volume blood samples from animals and humans. Talanta, v. 272, p. 125743, 2024.
GETACHEW, G et al. Tropical browses: contents of phenolic compounds, in vitro gas production and stoichiometric relationship between short chain fatty acid and in vitro gas production. The Journal of Agricultural Science, v. 139, p. 341-352, 2002.
KAMATH, P. S.; HOEPFNER, M. T.; PHILLIPS, S. F. Short-chain fatty acids stimulate motility of the canine ileum. The American Journal of Physiology, v. 253, p. G427–G433, 1987.
LAFLAMME, D. P. Development and Validation of a Body Condition Score System for Dogs. Canine Practice, v. 22, p. 10–15, 1997.
NELSON, D. L.; COX, M. M. Princípios de bioquímica de Lehninger. 7ª edição. Porto Alegre: Artmed Editora, 2019.
LINDON, J. C., HOLMES, E.; NICHOLSON, J. K. Pattern recognition methods and applications in biomedical magnetic resonance. Progress in Nuclear Magnetic Resonance Spectroscopy, v. 39, p. 1–40, 2001.
LOUIS, P. et al. Understanding the effects of diet on bacterial metabolism in the large intestine. Journal of Applied Microbiology, v. 102, p.1197–1208, 2007.
MORRISON, D. J.; PRESTON, T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism. Gut Microbes, v. 7, 189–200, 2016.
MÜLLER, M. et al., Circulating but not faecal short-chain fatty acids are related to insulin sensitivity, lipolysis and GLP-1 concentrations in humans. Scientific Reports, v. 9, p. 1–9, 2019.
MYHRSTAD M.C. et al., Dietary fiber, gut microbiota, and metabolic regulation— current status in human randomized trials, Nutrients, v. 12, p. 859, 2020.
NERY, J. et al. Influence of dietary protein content and source on colonic fermentative activity in dogs differing in body size and digestive tolerance. Journal of Animal Science, v. 90, p. 2570–2580, 2012.
POMARE, E. W.; BRANCH; W. J.; CUMMINGS, J. H. Carbohydrate fermentation in the human colon and its relation to acetate concentrations in venous blood. The Journal of Clinical Investigation, v. 75, v. 1448–1454, 1985.
SWANSON, K. S. et al. Supplemental fructooligosaccharides and mannanoligosaccharides influence immune function, ileal and total tract nutrient digestibilities, microbial populations and concentrations of protein catabolites in the large bowel of dogs. Journal of Nutrition, v. 132, p. 980–989. 2002.
TAN, J. et al. The role of short-chain fatty acids in health and disease. Advances in Immunology, v. 121, p. 91–119, 2014.
WALKER, W. A.; DUFFY, L. C. Diet and bacterial colonization: role of probiotics and prebiotics. The Journal of Nutrional Biochemistry, v. 9. p. 668–675, 1998.
 br
br
 es
es
 en
en



