

Orientador(a): Julio Cesar de Carvalho Balieiro
Instituição: Universidade de São Paulo
Trabalho Classificado na 10ª Edição (2024) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A obesidade é um dos principais problemas de saúde e bem-estar dos gatos em todo o mundo e deve-se à ingestão excessiva de alimentos ou ao gasto insuficiente de energia, o que provoca um balanço energético positivo. Apesar dos programas de perda de peso produzirem uma perda segura, há poucos estudos que relataram a relação da ingestão dos nutrientes essenciais em dietas coadjuvantes destinadas à redução do peso. Diante disso, o estudo avaliou as dietas coadjuvantes para perda de peso em gatos obesos e comparou se essas satisfaziam as necessidades nutricionais durante um programa de perda de peso. Foram avaliadas seis dietas coadjuvantes para gatos obesos disponíveis no mercado brasileiro. As dietas foram submetidas à análise bromatológica para extrato etéreo em hidrólise ácida. Os ácidos graxos essenciais também foram determinados e comparados em cada alimento. Os nutrientes fornecidos pelas dietas por quilo de peso corporal metabólico (kg PC0,67) de um gato obeso segundo a FEDIAF foram comparados com as recomendações, considerando as três equações mais utilizadas para o programa de emagrecimento: NEPP1: 85 x (PC)0.4, NEPP2: 0.8 x 70 x (PC x 0,8)0,75, e NEPP3: 70 x PC x 0.6 kcal/dia. Foi utilizado como modelo um gato obeso de 5 kg, com um peso meta de 4 kg (-20% do peso corporal atual). As análises foram avaliadas por estatística descritiva. Todas as dietas não atingiram a ingestão mínima recomendada de gordura por kg PC0,67 em todas as NEPPs. A dieta C e E apresentaram 7,91g e 6,45g de gordura total, respectivamente, teores considerados abaixo do mínimo recomendado para gatos em manutenção. Nenhuma dieta atendeu as necessidades mínimas de ácido araquidônico, um dos ácidos graxos essenciais aos gatos. Todas as dietas para emagrecimento de gatos comercializadas no Brasil apresentaram deficiências em gordura e ácido araquidônico, de acordo com as recomendações de ingestão por quilo de peso metabólico, segundo FEDIAF, implicando em risco no desenvolvimento de alterações metabólicas durante o programa de perda de peso e na aceitabilidade da dieta.
Palavras-chave: alimentos, felinos, nutrientes, obesidade.
Introdução
A deposição de tecido adiposo excessivo atrelado a maior ingestão energética e baixo gasto energético é reconhecida como doença multifatorial mais comum em gatos, a obesidade (Sallander et al., 2012). Estudos indicaram uma incidência de 11,5% e 63% de gatos em sobrepeso e obesos pelo mundo (Tarkosova et al., 2016). Já no Brasil, o único estudo que analisou a prevalência de gatos obesos foi durante a pandemia de COVID-19, a qual identificou cerca de 36,63% (Machado et al., 2023). Segundo McGreevy et al. (2008), essa prevalência aumenta conforme o avançar da idade, além de outros fatores como tipo de alimento, frequência alimentar, percepção dos tutores em relação a condição corporal do animal (Tarkosova et al., 2016). A obesidade pode provocar alterações metabólicas severas como a diabete mellitus (Sallander et al., 2012), lipidose hepática (Amstrong & Blanchard, 2009), doença periodontal (Chiang et al., 2022), doença dermatológica e claudicação (Öhlund et al., 2018), doença do trato urinário (Rahmiati et al., 2024), neoplasia e alterações gastrintestinais (Lund, 2005).
Com a finalidade de prevenir ou tratar a obesidade é importante realizar a avaliação nutricional, considerado o quinto parâmetro vital de uma anamnese, a qual promove um plano nutricional e alimentar adequado para promover qualidade, longevidade e bem-estar animal (Tarkosova et al., 2016). Conceber apenas uma dieta específica para a perda de peso, sem um acompanhamento nutricional, não é suficiente para resultar no emagrecimento (Michel & Scherk, 2012). Estudos demonstraram que um adequado protocolo de redução de peso associado a um plano alimentar acompanhado por um nutricionista resultaram no emagrecimento entre 294 dias (German et al., 2023) e 796 dias (Tvarijonaviciute et al., 2012).
Seguendo Christmann et al. (2016), o emagrecimento de gatos obesos foi capaz de melhorar a percepção dos tutores, ao observarem seus gatos apresentavam mais energia, disposição e felicidade. Apesar dos programas de perda de peso produzirem uma perda segura, há poucos estudos que relataram essa segurança em relação a ingestão dos nutrientes essenciais em dietas coadjuvantes (German et al., 2008; 2023). Diante dessa escassez na literatura científica, objetivou analisar e comparar as dietas coadjuvantes destinadas a gestão da obesidade em gatos, disponíveis no mercado brasileiro, em relação a quantidade recomendada de nutrientes por quilo de peso metabólico (kg PC0,67).
Material e métodos
A procura por alimentos para perda de peso em gatos obesos foi realizada via internet e utilizou-se as seguintes palavras-chave: “obesidade”, “perda de peso”, “weight loss” e “obesity”. Os alimentos foram adquiridos nas principais redes de pet shop da cidade de São Paulo em 2021. Um total de 6 alimentos foram adquiridos, o que representava todos os alimentos comercializados para a perda de peso em gatos obesos. Todos os alimentos foram submetidos a análises laboratoriais quanto a sua composição de extrato etéreo em hidrólise ácida (EEHA), segundo metodologias de AOAC (2006) e, ácidos graxos essenciais (AGE) de acordo com Shirai et al. (2005). Baseado nos resultados obtidos, foram comparados com as recomendações mínimas para cada macronutriente de acordo com FEDIAF (2021). Para estimar a ingestão de nutrientes por quilo de peso metabólico, foi utilizado um modelo de gato com peso de 5 kg, com escore de condição corporal 8 (Laflamme, 1997), escore de massa muscular 2/3 (Moxham, 2001) e peso meta calculado de 20% do peso vivo. A ingestão foi calculada de acordo com os resultados das dietas analisadas e a necessidade energética de perda de peso (NEPP) calculada a partir das três equações mais utilizadas para gatos: NEPP1 = 85 x (PC)0,4 (German et al., 2007), NEPP2 = 0.8 x 70 x (PC x 0,8)0,75 (Center, 2003) e NEPP3 = 70 x (PM) x 0,6
(Vasconcellos et al., 2009). O PM da última equação refere-se ao peso meta calculado e PC, peso corporal. Portanto, para a determinação consumida de cada nutriente por quilo de peso metabólico foi:
g de nutriente/kg PC0,67 = (NEPP/EM) x (VN/100)
PC0,67
onde EM refere-se a energia metabolizável do alimento e VN refere-se ao valor do nutriente analisado. As quantidades de nutrientes foram comparadas de acordo com as recomendações mínimas do FEDIAF (2021) por g/100g na matéria seca e por grama de nutriente por kg PC0,67. Os resultados e comparações são apresentados de forma descritiva.
Resultados e discussão
De acordo com as comparações entre as recomendações mínimas do FEDIAF, apenas dois alimentos (C e E) apresentaram valores inferiores de extrato etéreo (EE), conforme apresentado na Tabela 1.
Tabela 1. Composição química das dietas coadjuvantes destinadas a gatos obesos em comparação com os teores mínimos recomendados de EE segundo FEDIAF.

As necessidades nutricionais dos gatos são consideradas únicas, as quais surgiram da evolução decorrente de uma dieta específica de tecidos animais (Morris, 2002). A gordura é um dos macronutrientes essenciais aos gatos devido ao seu elevado fornecimento de energia e de ácidos graxos essenciais, além de transportar vitaminas lipossolúveis e ser um potencial palatabilizante determinante na aceitabilidade da dieta pelo animal. As dietas comerciais secas destinadas a gatos em manutenção possuem cerca de 9 a 15% de EE na matéria seca (MacDonald et al., 1984). Já as dietas de perda de peso analisadas continham uma média de 9,24%. Segundo Hoelmkjaer et al. (2014), quando a dose diária de energia é reduzida, todos os nutrientes serão reduzidos e poderão provocar deficiências. Todas as dietas analisadas, mesmo oferecendo teores acima da necessidade mínima de gordura (exceto C e E), proporcionaram deficiências lipídicas (Tabela 2).
Tabela 2. Quantidade de EE ingerida por kg0,67 nas diferentes dietas coadjuvantes para gatos obesos em comparação com as recomendações de ingestão diária da FEDIAF.

Essas deficiências poderão dificultar a aceitabilidade dos gatos à dieta, além de poder provocar deficiências nos ácidos graxos essenciais como o ácido araquidônico (ARA), ácido linolênico e ácido linoleico (NRC, 2006). Outros estudos demonstraram ingestões diária adequadas e superiores ao recomendado para todos os nutrientes essenciais em um programa de perda de peso em gatos (German et al., 2023). Geralmente, dietas comerciais para perda de peso para gatos asseguram uma ingestão adequada de nutrientes (Pathak et al., 2024), fato não encontrado no presente estudo.
Devido a deficiência encontrada de lipídio, espera-se que os ácidos graxos essenciais também apresentarão deficiências. Porém, todos os alimentos apresentaram valores acima do recomendado para o ácido linolênico. Já o ácido araquidônico (ARA), essencial para a reprodução (Chamberlin et al., 2011), crescimento, sistema dermatológico e imune (MacDonald et al., 1984), apresentou deficiência em todos os alimentos, exceto o alimento D, a qual não foi possível determinar nenhum ácido graxo essencial (Tabela 3). German et al. (2023) encontraram concentrações de ácido araquidônico acima do recomendado, porém, não analisaram se os valores apresentavam segurança quando comparados por quilo de peso metabólico.
Tabela 3. Quantidade de ácido araquidônico (ARA) ingerida por kg0,67 nas dietas coadjuvantes para gatos obesos em relação às recomendações de ingestão diária da FEDIAF.
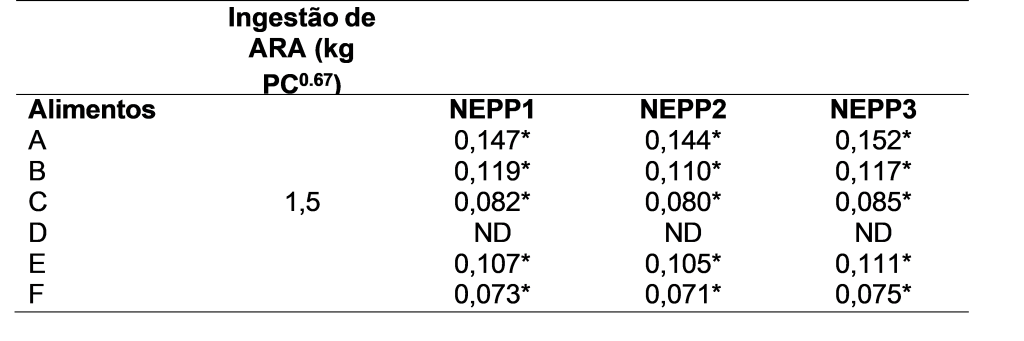
Animais alimentados com dietas desprovidas ou deficientes de ácidos graxos essenciais dessaturam o ácido monoinsaturado oleico (18:1, n-9), o qual resulta na produção de um biomarcador de deficiência em ácidos graxos essenciais (AGE), o ácido eicosatrienóico (20:3, n-9) (Bauer, 2006). Esse processo provoca dermatoses escamosas, pelagem desuniforme e sem brilho, seborreia, infertilidade comportamental, infiltração lipídica hepática (Rivers et al., 1976), mineralização dos rins e aumento no teor lipídico no fígado (MacDonald et al., 1984). O ARA possui conversões limitadas no organismo felino devido à baixa atividade da enzima Δ6- desaturase, o que resulta em baixas sínteses de ARA (Bauer, 2006). Por outro lado, estudos demonstraram uma atividade limitada da Δ6-desaturase no fígado e no cérebro em gatos recebendo uma dieta sem ARA por técnicas de isótopos estáveis combinadas com cromatografia gasosa e espectrometria de massa (Bauer, 2008). Trevizan et al. (2012) identificaram que os gatos são capazes de manter o ARA plasmático e dos glóbulos vermelhos quando alimentados com uma dieta desprovida de ARA mas com a adição de γ-linolenato.
A maioria dos estudos que avaliaram os diferentes alimentos para a manutenção da perda de peso em gatos, não avaliaram se a dieta apresenta deficiências de acordo com a quantidade de nutrientes por quilograma de peso metabólico. Apenas avaliaram se a dieta promoveu a perda de peso necessária e dentro do intervalo da taxa de perda de peso semanal de 0,5 a 1,0% (Pallotto et al., 2018). Pelos resultados encontrados, é necessária a comparação e análise das quantidades dos macronutrientes essenciais e seus produtos por quilo de peso metabólico, visando evitar deficiências e futuras alterações metabólicas. Dietas destinadas à perda de peso, além da composição dos ingredientes, devem levar em consideração o consumo, considerado essencial para o sucesso no tratamento da obesidade.
Conclusão
Todas as dietas avaliadas neste trabalho apresentaram deficiências importantes para a manutenção de uma vida saudável em gatos. Deficiências como em EE e ARA podem promover deficiências nutricionais, além de prejudicar a aceitabilidade do alimento. Neste contexto, a redução da aceitabilidade pode dificultar na continuidade do programa de perda de peso, acarretando em fracasso do programa de perda de peso.
Referências bibliográficas
Armstrong, P. J.; Blanchard, G. Hepatic lipidosis in cats. Veterinary Clinics: Small Animal Practice, v. 39, n. 3, p. 599-616, 2009.
AOAC Int. Official methods of analysis. Assoc. Offic. Anal, 2006.
Bauer, J. J. E. Essential fatty acid metabolism in dogs and cats. Revista Brasileira de Zootecnia, v. 37, p. 20-27, 2008.
Bauer, J. E. Metabolic basis for the essential nature of fatty acids and the unique dietary fatty acid requirements of cats. Journal of the American Veterinary Medical Association, v. 229, n. 11, p. 1729-1732, 2006.
Center, S. A. Clinical weight management for dogs and cats. In Resúmenes del III congreso de la World small animal veterinaty association, p. 56-69, 2003.
Christmann, U.; Bečvářová, I.; Werre, S. R.; Meyer, H. P. Effectiveness of a new dietetic weight management food to achieve weight loss in client-owned obese cats. Journal of feline medicine and surgery, v. 18, n. 12, p. 947-953, 2016.
Chiang, C. F.; Villaverde, C.; Chang, W. C.; Fascetti, A. J.; Larsen, J. A. Prevalence, risk factors, and disease associations of overweight and obesity in cats that visited the Veterinary Medical Teaching Hospital at the University of California, Davis from January 2006 to December 2015. Topics in companion animal medicine, v. 47, 2022.
FEDIAF. Nutritional guidelines for complete and complementary pet food for cats and dogs. European Pet Food Industry Federation Brussels, 2021.
German, A. J.; Woods-Lee, G. R.; Biourge, V.; Flanagan, J. Partial weight reduction protocols in cats lead to better weight outcomes, compared with complete protocols, in cats with obesity. Frontiers in Veterinary Science, 10, 2023.
German, A. J.; Holden, S.; Bissot, T.; Morris, P. J.; Biourge, V. Changes in body composition during weight loss in obese client-owned cats: loss of lean tissue mass correlates with overall percentage of weight lost. Journal of feline medicine and surgery, v. 10, n. 5, p. 452-459, 2008.
German, A. J.; Martins, L. Feline obesity: epidemiology, pathophysiology and management. Encyclopedia of feline clinical nutrition. Royal Canin, p. 3 – 49, 2007.
Hoelmkjaer, K. M.; Bjornvad, C. R. Management of obesity in cats. Veterinary Medicine: Research and Reports, p. 97-107, 2014.
Laflamme D. P. Development and validation of a body condition score for cats: a clinical tool, Feline Practice, v. 25, p. 13–18, 1997.
Lund E. M. Prevalence and risk factors for obesity in adult cats from private us veterinary practices. Interna-tional Journal of Applied Research in Veterinary Medicine, v. 3, p. 88–96,1995.
MacDonald, M. L.; Rogers, Q. R.; Morris, J. G. Nutrition of the domestic cat, a mammalian carnivore. Annual review of nutrition, v. 4, n. 1, p. 521-562, 1984.
Machado, B. D. S.; Bruno, C. E.; Silva, D. I. D.; Barth, J. C.; Santos, L. P. D.; Alves,
- S.; Pöppl, Á. G. An overweight/obesity survey among dogs and cats attended at a veterinary teaching hospital during the second year of the COVID-19
pandemic. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 74, p. 999- 1006, 2023.
McGreevy, P.; Thomson, P.; Pride, C.; Fawcett, A.; Grassi, T.; Jones, B. Overweight or obese cats presented to Australian veterinary practices: risk factors and prevalence. Australian Veterinary Practitioner, v. 38, n. 3, p. 98-100, 2008.
Michel, K.; Scherk, M. From problem to success: feline weight loss programs that work. Journal of feline medicine and surgery, v. 14, n. 5, p. 327-336, 2012.
Morris, J. G. Idiosyncratic nutrient requirements of cats appear to be diet-induced evolutionary adaptations. Nutrition research reviews, v. 15, n. 1, p. 153-168, 2002.
Moxham, G. Waltham feces scoring system – A tool for veterinarians and pet owners: how does your pet rate. Waltham focus, v. 11, n. 2, p. 24-5, 2001.
National Research Council. Nutrient requirements of dogs and cats. National Academies Press, 2006.
Öhlund, M.; Palmgren, M.; Holst, B. S. Overweight in adult cats: a cross-sectional study. Acta Veterinaria Scandinavica, v. 60, n. 1, p. 1-10, 2018.
Pallotto, M. R.; De Godoy, M. R.; Holscher, H. D.; Buff, P. R.; Swanson, K. S. Effects of weight loss with a moderate-protein, high-fiber diet on body composition, voluntary physical activity, and fecal microbiota of obese cats. American journal of veterinary research, v. 79, n. 2, p. 181-190, 2018.
Pathak, A.; Asediya, V.; Anjaria, P.; Singh, S. P. Nutritional and metabolic diseases of dogs and cats. In Introduction to Diseases, Diagnosis, and Management of Dogs and Cats. Academic Press, p. 429-457, 2024.
Rahmiati, D. U.; Balasubramaniam, G.; Sovinar, M.; Tampubolon, D. S. B.; Priyatna,
- S.; Yusrinabilla, Y.; Azizah, A. S. N. Feline lower urinary tract disease diagnosis in an obese sterile male Persian mixed-breed cat. ARSHI Veterinary Letters, v. 8,
- 1, p. 7-8, 2024.
Rivers, J. P. W.; Hassam, A. G.; Crawford, M. A.; Brambell, M. R. The absence of A-6 desaturase activity in the cat. Proceedings of the Nutrition Society, v. 35, 1976.
Sallander, M.; Eliasson, J.; Hedhammar, Å. Prevalence and risk factors for the development of diabetes mellitus in Swedish cats. Acta Veterinaria Scandinavica, v. 54, n. 1, p. 1-6, 2012.
SHIRAI, N.; SUZUKI, H.; WADA, S. Direct methylation from mouse plasma and from liver and brain homogenates. Analytical Biochemistry, v. 343, p. 48-53, 2005.
Tarkosova, D.; Story, M. M.; Rand, J. S.; Svoboda, M. Feline obesity-prevalence, risk factors, pathogenesis, associated conditions and assessment: a review. Veterinární Medicína, v. 61, n. 6, p. 295-307, 2016.
Trevizan, L.; de Mello Kessler, A.; Brenna, J. T.; Lawrence, P.; Waldron, M. K.; Bauer, J. E. Maintenance of Arachidonic Acid and Evidence of Δ5 Desaturation in Cats Fed γ‐Linolenic and Linoleic Acid Enriched Diets. Lipids, v. 47, n. 4, p. 413- 423, 2012.
Tvarijonaviciute, A.; Ceron, J. J.; Holden, S. L.; Morris, P. J.; Biourge, V.; German,
- J. Effects of weight loss in obese cats on biochemical analytes related to inflammation and glucose homeostasis. Domestic animal endocrinology, v. 42, n. 3, p. 129-141, 2012.
Vasconcellos, R. S.; Borges, N. C.; Goncalves, K. N.; Canola, J. C.; de Paula, F. J.; Malheiros, E. B.; Carciofi, A. C. Protein intake during weight loss influences the energy required for weight loss and maintenance in cats. The Journal of nutrition, v. 139, n. 5, p. 855-860, 2009.






