

Orientador(a): Bruna Agy Loureiro
Instituição: Universidade Federal da Bahia
Trabalho Classificado na 10ª Edição (2024) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A farinha de larva da mosca soldado-negro é um ingrediente seguro para uso em dietas de cães, possui alta digestibilidade, e é considerada uma adequada fonte de aminoácidos para atender os requerimentos de cães e gatos. Este estudo teve como objetivo avaliar o efeito da substituição de farinha de vísceras de frango por farinha de larva da mosca soldado-negro em dietas extrusadas para cães adultos saudáveis e o efeito na digestibilidade aparente dos nutrientes, produtos de fermentação intestinal, microbiota fecal e marcadores de saúde. Oito cães fêmeas, saudáveis, vacinadas e vermifugadas da raça beagle foram alocadas em um delineamento crossover, com dois períodos de 50 dias e duas dietas experimentais. Os cães foram alojados em canis individuais e alimentados duas vezes ao dia em quantidade para atender a 110kcal por kg0,75 (NRC, 2006) e água ad libitum. Foram determinados os teores de matéria seca, proteína bruta, cinzas, extrato etéreo em hidrólise ácida, fibra bruta, extrativos não nitrogenados, matéria orgânica, produção fecal (natural e seca), e energia bruta. Teores de ácidos graxos de cadeia curta (AGCC), ácidos graxos de cadeia ramificada (AGCR), lactato, amônia e pH foram determinados. Ao final de cada período experimental, foram coletadas fezes frescas para determinação de calprotectina e IgA e caracterização da microbiota fecal. Houve maior ingestão de fibra bruta pelos caes alimentados com LMSN. Houve uma maior concentração de amônia para o grupo FVA. IgA fecal foi encontrada em maior quantidade no grupo LMSN. A dieta FVA promoveu maior abundância relativa da família Lachnospiraceae, e os gêneros Bacteroidaceae CAG_462, Bacteroides e Phocaeicola foram mais abundantes na dieta LMSN. O uso deste ingrediente reduz o teor de amônia, potencialmente diminuindo o odor fecal, modula positivamente a microbiota intestinal devido ao seu efeito prebiótico e melhora o sistema imune de cães.
Introdução
A larva da mosca soldado-negro (LMSN, Hermetia illucens) é considerada uma das espécies mais promissoras devido a sua habilidade de crescimento em espaço reduzido, excelente conversão alimentar e habilidade de utilizar resíduos orgânicos de baixo valor nutricional e econômico transformando-os em proteína e gordura de alta qualidade (Van Huis et al., 2013; Valdés et al., 2022). A farinha de LMSN possui alta digestibilidade (Penazzi et al., 2021), e é considerada uma adequada fonte de aminoácidos para atender os requerimentos de cães e gatos (Oba et al., 2023). Além de uma ótima qualidade nutricional, a LMSN apresenta biomoléculas funcionais como a quitina, biopolímero encontrado no exoesqueleto de crustáceos e insetos (Ahmad et al., 2020). Estudos mostraram que a quitina se comporta de forma similar a fibra dietética não digerível (Bosch et al., 2016) e por isso, é capaz de modular a microbiota intestinal de cães (Jian et al., 2022).
Estudos avaliando o efeito do consumo da LMSN na microbiota intestinal e saúde nestes animais ainda não está muito bem descrito na literatura. Portanto, este estudo teve como objetivo avaliar o efeito da substituição de farinha de vísceras de frango por farinha de LMSN em dietas extrusadas para cães adultos saudáveis e o efeito na digestibilidade aparente dos nutrientes, produtos de fermentação intestinal, microbiota fecal e marcadores de saúde intestinal.
Material e métodos
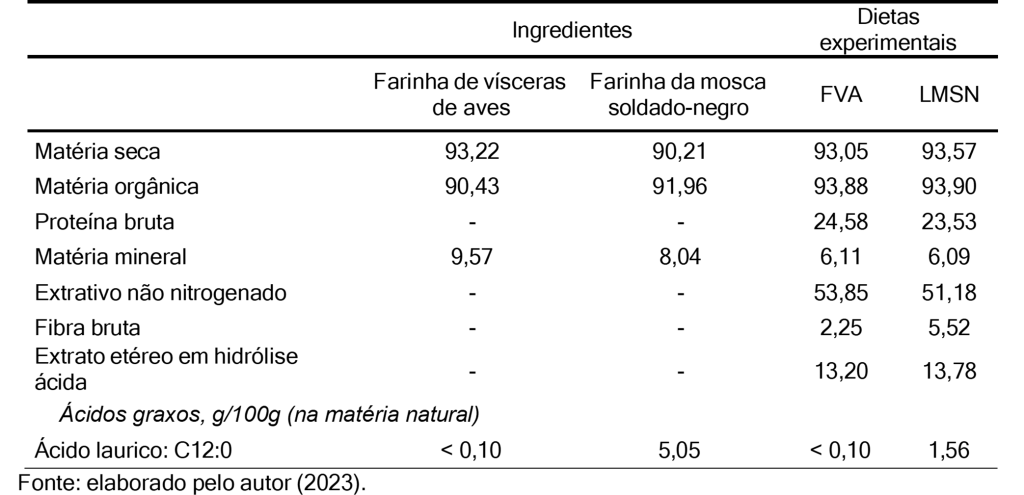
Todos os procedimentos foram previamente revisados e aprovados pela Comissão de Ética no Uso de Animais (CEUA nº 3149030322). Foram utilizadas duas dietas isonutritivas, uma contendo farinha de vísceras de aves de baixa cinza (FVA) e outra contendo farinha da mosca soldado-negro (LMSN) (Tabela 1). A análise química e o conteúdo de ácido láurico das farinhas e dietas experimentais estão indicados na Tabela 2. Oito cães fêmeas, saudáveis, vacinadas e vermifugadas da raça beagle foram alocadas em um delineamento crossover, com dois períodos de 50 dias e duas dietas experimentais. Os cães foram alojados em canis individuais e alimentados duas vezes ao dia em quantidade para atender a 110kcal por kg0,75 (NRC, 2006) e água ad libitum.

Os coeficientes de digestibilidade aparente (CDA) foram determinados pela coleta total de fezes (sem coleta de urina) de acordo com AAFCO (2014), com 15 dias de adaptação previa a dieta. Durante a coleta das fezes, determinou-se o escore fecal de acordo com Carciofi et al. (2008). Após a coleta, as fezes coletadas foram pesadas, identificadas e congeladas -15°C para posterior análise. Foram determinados os teores de matéria seca (MS), proteína bruta (PB), cinzas, extrato etéreo em hidrólise ácida (EEHA) e fibra bruta (FB) de acordo com a AOAC (1995). Extrativos não nitrogenados, matéria orgânica e produção fecal (natural e seca) foram estimados por cálculos. A energia bruta foi determinada em bomba calorimétrica.
Aos 20 dias de cada período, foram coletadas amostras de fezes frescas, durante três dias, em no máximo 15min após a defecação para determinação dos teores de ácidos graxos de cadeia curta (AGCC), ácidos graxos de cadeia ramificada (AGCR), lactato, amônia e pH. Durante a coleta, aferiu-se o pH fecal. Os AGCC e AGCR foram determinados por cromatografia gasosa, e o ácido lático por cromatografia líquida de alta eficiência. Para determinação da concentração de amônia (N-NH3) utilizou-se o método Kjeldahl (Vieira, 1980), com adaptações.
Ao final de cada período experimental, 5g de fezes frescas para a determinação de calprotectina e IgA e 1g do interior de fezes frescas para a caracterização da microbiota fecal foram coletadas. Para determinação da calprotectina fecal foi utilizado o kit ELISA para calprotectina canina nº SEK504Ca e para a quantificação de IgA fecal foi realizada utilizando o kit ELISA para determinação de IgA canina nº ECA0026, ambos seguindo metodologia descrita pelo fabricante. Para caracterização da microbiota fecal, o DNA foi extraído utilizando kit comercial conforme protocolo do fabricante, seguido de quantificação por espectrofotometria a 260nm. A integridade foi avaliada por eletroforese em gel de agarose a 1%.
O DNA foi amplificado por PCR, foram utilizados primers universais em um segmento de aproximadamente 460 bases das regiões V3-V4 do 16S rRNA. Todos os amplicons obtidos foram utilizados para a construção da livraria metagenômica através de kits comerciais, agrupados e posteriormente sequenciados por sequenciador (Degnan e Ochman, 2012). As sequências obtidas foram analisadas na plataforma QIIME2 (Quantitative Insights Into Microbial Ecology) (Caporaso et al., 2010a; Caporaso et al., 2010b) e classificadas através do reconhecimento de Variantes de Sequência de Amplicon (ASVs), comparando as sequências com a atualização (GTDB 202) do ano 2021 do Banco de Dados de Taxonomia do Genoma (Parks et al., 2022) de sequências montadas.
Todas as variáveis foram verificadas quanto à distribuição normal pelo teste de Shapiro-Wilk. Dados de digestibilidade, produtos de fermentação intestinal, produção fecal, calprotectina e imunoglobulina fecal foram analisados utilizando ANOVA por teste T. O escore fecal foi analisado por Kruskall-Wallis. Todas as médias foram comparadas por teste de Tukey-Kramer. As análises estatísticas foram realizadas utilizando o software SigmaPlot v.12.0 a 5% de significância. Para análise metagenômica, o teste Mann-Whitney, foi utilizado para determinar a diversidade alfa e a diversidade beta foi realizada pelo perMANOVA do pipeline Qiime2, utilizando um número de 10.000 permutações. As análises estatísticas foram calculadas em “R”. A diversidade alfa foi calculada pela biblioteca “phyloseq” (McMurdie; Holmes, 2013), “vegan” (Oksanen et al., 2007) e “microbiome” (Lahti; Shetty, 2018). As diferenças nas abundâncias relativas dos táxons entre os grupos analisados foram estimadas pelo teste de Mann-Whitney, considerando como estatisticamente significativos resultados inferiores a p<0,05.
Resultados
Foi possível extrusar a dieta substituindo completamente a FVA pela LMSN. Os cães apresentaram boa aceitação das dietas durante todo o ensaio, sem nenhum episódio de efeito adverso. O consumo alimentar médio durante o período foi de 26,03±3,23g e 25,77±3,82 g/kg0,75/dia para FVA e LMSN, respectivamente. A ingestão de nutrientes (g/kg0,75/dia MS) foi semelhante nas duas dietas, exceto na ingestão de FB (p<0,001) que foi maior para os cães alimentados com a LMSN. Os CDA foram diferentes para EEHA (p=0,011) e EM (p=0,069) ambos sendo maiores para os cães alimentados com a dieta LMSN.
A produção fecal em matéria natural (MN) tendeu à significância (p=0,095), com maior produção de massa fecal em cães alimentados com dieta LMSN. Houve diferença significativa (P<0,05) nas concentrações de N-NH3 entre os tratamentos, com maior concentração (P=0,004) para o grupo FVA, além dos AGCR tendendo a ser maior (p=0,093) para esse grupo. Entretanto, a digestibilidade da PB entre as dietas foi semelhante (P=0,841). Não houve diferença na calprotectina fecal, mas foi observado aumento na concentração de IgA no grupo LMSN (P=0,045).
Não houve diferença (P>0,05) na diversidade alfa (Chao1, Observed OTUs, Fisher, Simpson, Shannon e Evenness Pielou). Contudo, houve diferença para a diversidade beta (pelos parâmetros Bray-Curtis (P=0,009299), Jaccard (P=0,036596), UniFrac (P=0,005799) e Weighted UniFrac (P=0,005899)). A dieta FVA promoveu maior abundância relativa da família Lachnospiraceae (P=0,0289), e os gêneros Bacteroidaceae CAG_462 (P=0,0093), Bacteroides (P=0,014) e Phocaeicola (P=0,014) foram mais abundantes na dieta LMSN.
Discussão
A maior ingestão de FB, pelos animais alimentados com a LMSN deve-se ao maior teor de FB da dieta contendo LMSN, fato que pode estar associado a presença da quitina no exoesqueleto dos insetos, que por apresentar estrutura molecular semelhante a celulose, pode influenciar a determinação de FB (Bosch et al., 2016). A maior digestibilidade do EEHA corrobora com resultados da literatura (Abd El- Wahab et al., 2021). Insetos possuem altos teores de gordura (Van Huis, 2013) e seu alto coeficiente de digestibilidade aparente da gordura pode estar relacionado com tipo de lipídio (Asaro et al., 2017). O perfil lipídico dos ácidos graxos do ingrediente FVA e LMSN são diferentes e podem ter contribuído para as diferenças de digestibilidade de EEHA observadas no presente estudo.
A tendência para maior quantidade de fezes úmidas nos cães alimentados com a LMSN, corrobora com Abd El-Wahab et al. (2021). A umidade fecal é maior quando há maior presença de fibra na dieta ingerida (Cole et al., 1999; Fahey et al., 1990). Esse aumento pode estar relacionado a quitina, considerada fibra alimentar nas dietas de cães. Resultado semelhante nas concentrações de N-NH3 foi encontrado por Kröger et al. (2020) e Nery et al. (2012). A concentração de N-NH3 nas fezes está relacionada ao mau odor fecal, podendo afetar negativamente a funcionalidade intestinal (Souza et al. 2021) e estão associados às frações proteicas não digeridas que são fermentadas no cólon.
A calprotectina e a IgA fecal são marcadores não invasivos da saúde intestinal em cães (Grellet et al., 2014). A medição da calprotectina permite rastrear e identificar a inflamação intestinal em cães (Felix et al., 2022), no nosso estudo não houve diferenças na calprotectina. Por outro lado, as concentrações de IgA aumentaram quando os cães consumiram dietas à base de LMSN. Quando as concentrações de IgA estão elevadas, indica que há aumento da imunidade da mucosa (Lin et al., 2020), pois a IgA secretada no intestino protege a mucosa de patógenos, eliminando-os e evitando o contato com a superfície das células epiteliais (Corthesy; Kraehenbuhl, 1999). Assim, a dieta baseada em LMSN não é prejudicial à saúde intestinal dos cães e pode melhorar a imunidade intestinal.
A família Lachnospiraceae está relacionada em alguns distúrbios metabólicos e condições inflamatórias intestinais (Vacca et al., 2020). No presente estudo, o grupo consumindo LMSN apresentou menor abundância relativa, sendo um indicativo de que a LMSN pode auxiliar em distúrbios metabólicos e inflamações intestinais. A dieta LMSN promoveu maior abundância relativa dos gêneros Bacteroidaceae CAG_462, Bacteroides e Phocaeciola pertencentes a família Bacteroidaceae, essa família é encontrada em microbiota intestinal de cães saudáveis. O gênero Bacteroidaceae CAG_462 é um gênero desconhecido encontrado na biblioteca do sequenciamento utilizado. Bacteroides é considerado o maior produtor de AGCR, especialmente acetato (Souza et al., 2021), que aumenta a permeabilidade intestinal (Suchodolski et al., 2012). Phocaeicola é considerado um biomarcador da saúde humana (Wang et al., 2021). Em cães, um estudo recente (Kwong et al., 2023) comparando a microbiota de cães com diabetes mellitus canina e cães saudáveis, observaram que a população de uma espécie (P. plebeius) do gênero Phocaeicola aumentou nos cães diabéticos, devido a alteração na modulação da microbiota intestinal destes cães por conta da alta concentração de carboidratos.
Conclusão
Recomenda-se a substituição total de farinha de vísceras de frango de baixa cinzas por farinha desengordurada de mosca soldado negro, pois a H. illucens não diminui a digestibilidade aparente da dieta e apresenta alta digestibilidade da gordura. Além disso, o uso deste ingrediente reduz o teor de amônia, potencialmente diminuindo o odor fecal, modula positivamente a microbiota intestinal devido ao seu efeito prebiótico e melhora o sistema imune de cães.
Referências bibliográficas
ABD EL-WAHAB, A.; MEYER, L.; KÖLLN, M.; CHUPPAVA, B.; WILKE, V.; VISSCHER, C.; KAMPHUES, J. Insect Larvae Meal (Hermetia illucens) as a Sustainable Protein Source of Canine Food and Its Impacts on Nutrient Digestibility and Fecal Quality. Animals, v. 11, n. 9, p. 2525, 27 ago. 2021.
https://doi.org/10.3390/ani11092525
AHMAD, S. I. AHMAD, R., KHAN, M. S.; KANT, R.; SHAHID, S.; GAUTAM, L.;
HASAN, G. M.; HASSAN, M. I. Chitin and its derivatives: Structural properties and biomedical applications. International Journal of Biological Macromolecules, v. 164, p. 526–539, dez. 2020. https://doi.org/10.1016/j.ijbiomac.2020.07.098
Asaro, N.J., Guevara, M.A., Berendt, K., Zijlstra, R. and Shoveller, A.K., 2017. Digestibility is similar between commercial diets that provide ingredients with different perceived glycemic responses and the inaccuracy of using the modified Atwater Calculation to Calculate Metabolizable Energy. Veterinary Sciencies.
8;4(4):54. http://doi.org/10.3390/vetsci4040054
Association of American Feed Control Officials (AAFCO), 2014. Official publication. Oxford Association of the Official Analitical Chemists (AOAC), 1995. Official and Tentative Methods of Analysis, 16.Ed. Washington, DC: AOAC International BOSCH, G.; VERVOORT, J. J. M.; HENDRIKS, W. H. In vitro digestibility and fermentability of selected insects for dog foods. Animal Feed Science and Technology, v. 221, p. 174–184, nov. 2016. https://doi.org/10.1016/j.anifeedsci.2016.08.018
CAPORASO, J. G.; KUCZYNSKI, J.; STOMBAUGH, J.; BITTINGER, K.; BUSHMAN, F. D.; COSTELLO, E. K.; FIERER, N.; PEÑA, A. G.; GOODRICH, J.
K.; GORDON, J. I. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, v. 7, n. 5, p. 335–336, 11 abr. 2010a. https://doi.org/10.1038/nmeth.f.303
CAPORASO, J. G.; LAUBER, C. L.; WALTERS, W. A.; BERG-LYONS, D.; LOZUPONE, C. A.; TURNBAUGH, P. J.; FIERER, N.; KNIGHT, R. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample.
Proceedings of the National Academy of Sciences, v. 108, n. Supplement_1, p. 4516–4522, 3 jun. 2010b. https://doi.org/10.1073/pnas.1000080107
CARCIOFI, A. C.; TAKAKURA, F. S.; DE-OLIVEIRA, L. D.; TESHIMA, E.; JEREMIAS, J. T.; BRUNETTO, M. A.; PRADA, F. Effects of six carbohydrate sources on dog diet digestibility and post-prandial glucose and insulin response. Journal of Animal Physiology and Animal Nutrition, v. 92, n. 3, p. 326–336, jun. 2008. https://doi.org/10.1111/j.1439-0396.2007.00794.x
COLE, J. T.; FAHEY, G. C.; MERCHEN, N. R.; PATIL, A. R.; MURRAY, S. M.; HUSSEIN, H. S.; BRENT, J. L. Soybean hulls as a dietary fiber source for dogs. Journal of Animal Science, v. 77, n. 4, p. 917–917, 1 jan. 1999. https://doi.org/10.2527/1999.774917x
CORTHESY, B.; KRAEHENBUHL, J.-P. Antibody-Mediated Protection of Mucosal Surfaces. Current Topics in Microbiology and Immunology, p. 93–111, 1 jan. 1999. https://doi.org/10.1007/978-3-642-59951-4_6
DEGNAN, P. H.; OCHMAN, H. Illumina-based analysis of microbial community diversity. The ISME Journal, v. 6, n. 1, p. 183–194, 16 jun. 2011. https://doi.org/10.1038/ismej.2011.74
FAHEY, G. C.; MERCHEN, N. R.; CORBIN, J. E.; HAMILTON, A. K.; SERBE, K. A.; LEWIS, S. M.; HIRAKAWA, D. A. Dietary fiber for dogs: I. Effects of graded levels of dietary beet pulp on nutrient intake, digestibility, metabolizable energy and digesta mean retention time. Journal of Animal Science, v. 68, n. 12, p. 4221– 4228, 1 dez. 1990. https://doi.org/10.2527/1990.68124221x
FÉLIX, A. P.; SOUZA, C. M. M.; DE OLIVEIRA, S. G. Biomarkers of gastrointestinal functionality in dogs: A systematic review and meta-analysis. Animal Feed Science and Technology, v. 283, p. 115183, jan. 2022. https://doi.org/10.1016/j.anifeedsci.2021.115183
GRELLET, A.; Heilmann, R. M.; Polack, B.; Feugier, A.; Boucraut-Baralon, C.; Grandjean, D.; Grutzner, N.; Suchodolski, J. S.; Steiner, J. M.; Chastant-Maillard,
- Influence of Breed Size, Age, Fecal Quality, and Enteropathogen Shedding on Fecal Calprotectin and Immunoglobulin A Concentrations in Puppies During the
Weaning Period. Journal of Veterinary Internal Medicine, v. 30, n. 4, p. 1056– 1064, 8 jun. 2016. https://doi.org/10.1111/jvim.14255
JIAN, S.; ZHANG, L.; DING, N.; YANG, K.; XIN, Z.; HU, M.; ZHOU, Z.; ZHAO, Z.; DENG, B.; DENG, J. Effects of black soldier fly larvae as protein or fat sources on apparent nutrient digestibility, fecal microbiota, and metabolic profiles in beagle dogs. Frontiers in Microbiology, v. 13, 25 nov. 2022. https://doi.org/10.3389/fmicb.2022.1044986
KWONG, T. C.; CHAU, E. C. T.; MAK, M. C. H.; CHOY, C. T.; CHAN, L. T.; PANG, C. K.; ZHOU, J.; POON, P. H. C.; GUAN, Y.; TSUI, S. K. W.; CHAN, S. W.; LEUNG, G. P. H.; TAI, W. C. D.; KWAN, Y. W. Characterization of the Gut Microbiome in Healthy Dogs and Dogs with Diabetes Mellitus. Animals, v. 13, n. 15, p. 2479, 1 jan. 2023. https://doi.org/10.3390/ani13152479
KRÖGER, S.; HEIDE, C.; ZENTEK, J. Evaluation of an extruded diet for adult dogs containing larvae meal from the Black soldier fly (Hermetia illucens). Animal Feed Science and Technology, v. 270, p. 114699, dez. 2020. https://doi.org/10.1016/j.anifeedsci.2020.114699
LAHTI, L.; SHETTY, S. Introduction to the microbiome R package. 2018.
LIN, C.-Y.; JHA, A. R.; OBA, P. M.; YOTIS, S. M.; SHMALBERG, J.; HONAKER, R.
W.; SWANSON, K. S. Longitudinal fecal microbiome and metabolite data demonstrate rapid shifts and subsequent stabilization after an abrupt dietary change in healthy adult dogs. Animal Microbiome, v. 4, n. 1, 1 ago. 2022. https://doi.org/10.1186/s42523-022-00194-9
MCMURDIE, P. J.; HOLMES, S. Phyloseq: An R Package for Reproducible Interactive Analysis and Graphics of Microbiome Census Data. PLoS ONE, v. 8, n. 4, p. e61217, 22 abr. 2013. https://doi.org/10.1371/journal.pone.0061217
Nacional Research Council (US), 2006. Nutrient Requirements of Dogs and Cats. Washington (DC): Rev. National Academies Press. NERY, J.; GOUDEZ, R.; BIOURGE, V.; TOURNIER, C.; LERAY, V.; MARTIN, L.; THORIN, C.; NGUYEN, P.; DUMON, H. Influence of dietary protein content and source on colonic fermentative activity in dogs differing in body size and digestive
tolerance1. Journal of Animal Science, v. 90, n. 8, p. 2570–2580, 1 ago. 2012. https://doi.org/10.2527/jas.2011-4112
OBA, P. M.; UTTERBACK, P. L.; LONGSHAW, M.; PARSONS, C. M.; SWANSON, K. S. Comparing the standardized amino acid digestibility of an alternative protein source with commercially available protein-based ingredients using the precision-fed cecectomized rooster assay. Journal of Animal Science, v. 101, 1 jan. 2023. https://doi.org/10.1093/jas/skad236
OKSANEN, J.; KINDT, R.; LEGENDRE, P.; O’HARA, B.; HENRY, M.; STEVENS, H. The Vegan Package. 03 nov, 2007. PARKS, D. H.; CHUVOCHINA, M.; RINKE, C.; MUSSIG, A. J.; CHAUMEIL, P. -A.; HUGENHOLTZ, P. GTDB: an ongoing census of bacterial and archaeal diversity through a phylogenetically consistent, rank normalized and complete genome- based taxonomy. Nucleic Acids Research, 14 set. 2021. https://doi.org/10.1093/nar/gkab776
PENAZZI, L.; SCHIAVONE, A.; RUSSO, N.; NERY, J.; VALLE, E.; MADRID, J.; MARTINEZ, S.; HERNANDEZ, F.; PAGANI, E.; ALA, U.; PROLA, L. In vivo and in vitro Digestibility of an Extruded Complete Dog Food Containing Black Soldier Fly (Hermetia illucens) Larvae Meal as Protein Source. Frontiers in Veterinary Science, v. 8, 11 jun. 2021. https://doi.org/10.3389/fvets.2021.653411
RAJILIĆ-STOJANOVIĆ, M.; DE VOS, W. M. The first 1000 cultured species of the human gastrointestinal microbiota. FEMS Microbiology Reviews, v. 38, n. 5, p. 996–1047, set. 2014. https://doi.org/10.1111/1574-6976.12075
SOUZA, C. M. M.; BASTOS, T. S.; KAELLE, G. C. B.; BORTOLO, M.; VASCONCELLOS, R. S.; OLIVEIRA, S. G.; FÉLIX, A. P. Comparison of cassava fiber with conventional fiber sources on diet digestibility, fecal characteristics, intestinal fermentation products, and fecal microbiota of dogs. Animal Feed Science and Technology, v. 281, p. 115092, nov. 2021. https://doi.org/10.1016/j.anifeedsci.2021.115092
SUCHODOLSKI, J. S.; MARKEL, M. E.; GARCIA-MAZCORRO, J. F.; UNTERER, S.; HEILMANN, R. M.; DOWD, S. E.; KACHROO, P.; IVANOV, I.; MINAMOTO, Y.; DILMAN, E. M.; STEINER, J. M.; COOK, A. K.; TORESSON, L. The Fecal
Microbiome in Dogs with Acute Diarrhea and Idiopathic Inflammatory Bowel Disease. PLoS ONE, v. 7, n. 12, p. e51907, 26 dez. 2012. https://doi.org/10.1371/journal.pone.0051907
VACCA, M.; CELANO, G.; CALABRESE, F. M.; PORTINCASA, P.; GOBBETTI, M.; DE ANGELIS, M. The Controversial Role of Human Gut Lachnospiraceae. Microorganisms, v. 8, n. 4, 15 abr. 2020. https://doi.org/10.3390/microorganisms8040573
VALDÉS, F. VILLANUEVA, V.; DURÁN, E.; CAMPOS, F.; AVENDAÑO, C.; SÁNCHEZ, M.; DOMINGOZ-ARAUJO, C.; VALENZUELA, C. Insects as Feed for
Companion and Exotic Pets: A Current Trend. Animals, v. 12, n. 11, p. 1450, 3 jun. 2022. https://doi.org/10.3390/ani12111450
VAN HUIS, A.; VAN ITTERBEECK, J.; KLUNDER, H.; MERTENS, E.; HALLORAN, A.; MUIR, G.; VANTOMME, P. Edible insects: future prospects for food and feed security. FAO Forestry Paper no. 171. Food and Agriculture Organization of the United Nations (FAO), Rome, Italy, p. 187, 2013. Disponível em: <http://www.fao.org/docrep/018/i3253e/i3253e.pdf>
VIEIRA, P. F. Efeito do formaldeído na proteção de proteínas e lipídios em rações para ruminantes. 1980. 98p. Tese (Doutorado em Zootecnia) – Universidade Federal de Viçosa, Viçosa. 1980.
WANG, H.; REHMAN, K. U.; FENG, W.; YANG, D.; REHMAN, R. U.; CAI, M.; ZHANG, J.; YU, Z.; ZHENG, L. Physicochemical structure of chitin in the developing stages of black soldier fly. International Journal of Biological Macromolecules, v. 149, p. 901–907, abr. 2020. https://doi.org/10.1016/j.ijbiomac.2020.01.293
 br
br
 es
es
 en
en





