

Orientador(a): Fernanda Chicharo Chacar
Instituição: Faculdade de Medicina Veterinária e Zootecnia – Universidade de São Paulo
Trabalho Classificado na 10ª Edição (2024) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A microbiota intestinal é reconhecida como um órgão metabolicamente ativo e essencial para a manutenção da homeostase do organismo. Fatores como dieta, estresse, genética, ambiente e hormônios desempenham papéis fundamentais no equilíbrio (simbiose) e na modulação da microbiota intestinal. Em pacientes com doença renal crônica (DRC), a ruptura da simbiose leva a um estado de disbiose, contribuindo para o componente inflamatório da doença, devido às alterações na população microbiana, que afetam a permeabilidade da barreira intestinal e liberam mediadores pró-inflamatórios e endotoxinas na circulação. A disbiose intestinal associada à DRC favorece o acúmulo de toxinas urêmicas, como indoxil sulfato (IS) e p-cresol sulfato (pCS), devido à maior prevalência de famílias bacterianas produtoras dessas toxinas. Por sua vez, o acúmulo de toxinas urêmicas promove ainda mais disbiose, além de afetar a atividade intestinal, levando à redução da motilidade colônica e à gastroenteropatia urêmica. As intervenções clínicas, como: aumento do teor de fibras na dieta, uso de prebióticos, probióticos, simbióticos e adsorventes se mostram estratégias promissoras para a restauração da simbiose e redução da progressão da DRC, no entanto, são necessários mais estudos para comprovar sua eficácia. Portanto, esta revisão tem por objetivo explorar a relação do eixo entero-renal com a progressão da DRC, assim como o papel da modulação da microbiota intestinal para mitigar seus efeitos.
Introdução
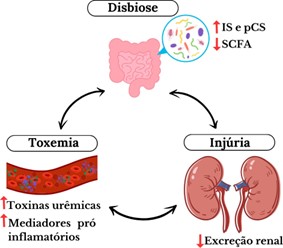
O eixo entero-renal é caracterizado pela interação patogênica entre a microbiota intestinal e doenças renais, dentre elas, a doença renal crônica (DRC). A DRC, por sua vez, contribui para a modificação na composição e função da microbiota, resultando em disbiose (Kim; Song, 2020). Tal disbiose é dada pelo desequilíbrio no perfil microbiológico intestinal, com predomínio de grupos bacterianos produtores de toxinas (Cunha; Stinghen, 2018) e diminuição da excreção destas devido à disfunção renal (Glassock; Massry, 2022). Essas alterações também podem resultar do uso frequente de antibióticos, variações na dieta, baixa ingestão de fibras e utilização de quelantes de fósforo (Summers et al., 2019).
A simbiose da microbiota intestinal é crucial para a manutenção da homeostase do organismo, desempenhando funções defensivas contra agentes agressores e promovendo mecanismos de reparo, como a preservação da integridade da barreira intestinal e a resistência à colonização por bactérias patogênicas, mediada pela produção de proteínas antimicrobianas (AMPs). No entanto, a disbiose pode comprometer a integridade da barreira mucosa, aumentando sua permeabilidade e permitindo translocação bacteriana, o que por sua vez induz um estado pró-inflamatório no tecido renal (Stavropoulou et al., 2020).
Portanto, a relação entre DRC e disbiose é bidirecional: enquanto a DRC resulta na ruptura da simbiose do organismo, a disbiose influencia a progressão desta doença. Assim, a modulação da microbiota pelo uso de prebióticos, probióticos, simbióticos e adsorventes é reconhecida como o padrão- ouro para o tratamento e prevenção da disbiose (Stavropoulou et al., 2020), além de uma terapia adjuvante promissora no controle da progressão da DRC (Kim; Song, 2020).
Disbiose, DRC e toxinas urêmicas – qual a relação entre elas?
Os metabólitos microbianos associados à DRC podem ser classificados como prejudiciais e renoprotetores. Os metabólitos renoprotetores, como os ácidos graxos de cadeia curta (SCFAs) inibem os danos renais, enquanto os prejudiciais, como o indoxil sulfato (IS) e o p-cresil sulfato (pCS) favorecem à progressão da DRC. Tais toxinas urêmicas oriundas da microbiota, foram associadas a morbidade na DRC (Summers et al., 2019), em que há maior quantidade de bactérias produtoras de enzimas indol e p-cresol conforme o avanço da doença (Kim; Song, 2020; Stavropoulou et al., 2020; Wehedy; Shatat; Al Khodor, 2022).
No intestino predominam as bactérias anaeróbias, responsáveis pela produção de SCFAs (Huang et al., 2017) e conversão dos aminoácidos tirosina em p-cresol e triptofano em indol, que devem sofrer metabolização hepática ou colônica em pCS e IS, respectivamente, e eliminação renal. Contudo, diante da redução da função renal na DRC, há o aumento da concentração dessas toxinas na circulação, resultando, na alteração do perfil microbiológico intestinal (Nallu et al., 2017; Ramos et al., 2020). Com isso, a microbiota benéfica diminui gradativamente, levando à queda dos níveis de SCFAs, que atuam na nutrição dos colonócitos e na supressão de mediadores inflamatórios (Stavropoulou et al., 2020).
O IS é uma toxina mediadora da expressão de genes relacionados à fibrose intersticial e um fator indutor de inflamação de podócitos. Estudos demonstraram que a neutralização do IS em ratos urêmicos está associada ao retardo da progressão da DRC (Lambert et al., 2023). Já o pCS atua elevando a síntese de espécies reativas de oxigênio (EROs) (Nallu et al., 2017; Kim; Song, 2020), resultando na apoptose de células renais (Andrade-Oliveira et al., 2015). Em estudos realizados com camundongos parcialmente nefrectomizados, o IS e pCS estimularam a ativação do sistema renina-angiotensina-aldosterona intrarenal (SRAA), levando a fibrose intersticial e glomeruloesclerose (Kim; Song, 2020).
Estudos em felinos demonstraram uma correlação entre a DRC, a diminuição da diversidade da microbiota fecal e a maior concentração de IS. No entanto, ao contrário do observado em humanos e ratos, não foi encontrada correlação entre as bactérias produtoras de indol e p-cresol e as concentrações séricas de IS e pCS em felinos (Summers et al., 2019). Além disso, em cães e gatos a concentração de IS está correlacionada ao grau de perda da função renal e azotemia, com pacientes em estágio 4 apresentando concentrações mais altas dessa toxina (Cheng et al., 2015). Ressalta-se que o papel do pCS carece de estudos para elucidar sua função na medicina veterinária (Summers et al., 2019).
Eixo-enterorenal - como se retroalimenta?
A concentração de ureia é proporcional às alterações na microbiota (Stavropoulou et al., 2020), já que a diminuição da função renal leva ao acúmulo de toxinas urêmicas, favorecendo a colonização de bactérias conversoras de uréia em amônia (ureases) (Vaziri et al., 2013). Com isso, há a alteração do pH luminal, resultando em enterocolite urêmica devido à quebra das junções estreitas epiteliais dos enterócitos, o que favorece a endotoxemia, a inflamação sistêmica e o estresse oxidativo, acelerando a progressão da lesão renal (Huang et al., 2017; Stavropoulou et al., 2020). Com a progressão da DRC, há a substituição da via de excreção renal do ácido úrico pela colônica, favorecendo o crescimento de ureases e retroalimentando esse processo (Vaziri et al., 2013; Kim; Song, 2020).
Na DRC, além da disbiose, a maior permeabilidade intestinal pode ser atribuída à liberação de lipopolissacarídeos (LPS), cuja concentração aumenta conforme o progresso da doença (Lambert et al., 2023), induzindo a liberação de mediadores inflamatórios e causando estresse oxidativo, comprometimento da resposta imune (Stavropoulou et al., 2020) e resposta inflamatória sistêmica (Kim; Song, 2020).
A constipação é um achado comum em distúrbios que levam à desidratação, como: DRC, diabetes mellitus ou alterações intestinais. Além disso, pode ocorrer como efeito colateral ao uso de medicamentos. Os gatos com DRC apresentam alta correlação com quadros de constipação (Benjamin; Drobatz, 2020), possivelmente devido a desequilíbrios hidroeletrolíticos, alterações fisiológicas e manejo medicamentoso da doença (Jones et al., 2022). Em humanos a constipação está relacionada à redução da motilidade intestinal, o que eleva a retenção de p-cresol no cólon e, portanto, sua absorção, resultando no aumento da síntese de pCS. Além disso, a constipação pode induzir disbiose, modificando a microbiota e favorecendo a produção de toxinas urêmicas (Ramos et al., 2020).
Modulação dietética
Embora a dieta seja essencial na formação da microbiota, pacientes nefropatas possuem restrições que podem influenciar a função microbiana (Stavropoulou et al., 2020), as quais levam ao consumo reduzido de carboidratos não estruturais, que são precursores de SCFAs (Kim; Song, 2020). A produção de IS e pCS pode ser modulada através do aumento seletivo de bactérias sacarolíticas (produtoras de SCFAs) e diminuição das proteolíticas (produtoras de resíduos nitrogenados) no cólon. Portanto, a abordagem terapêutica deve visar a restauração da simbiose, o que pode ser realizado através do manejo dietético, ajuste no tempo de trânsito intestinal, uso de probióticos, prebióticos, simbióticos, SCFAs e adsorventes (Summers et al., 2019; Kim; Song, 2020; Stavropoulou et al., 2020).
O manejo dietético inclui o aumento da ingestão de fibras, principalmente o amido resistente, que atua como substrato para bactérias benéficas, reduzindo o estresse oxidativo, a inflamação e restaurando as junções estreitas epiteliais dos enterócitos. Contudo, essa dieta pode apresentar concentrações elevadas de potássio e fósforo, limitando seu uso em estágios avançados da doença (Kim; Song, 2020). Os adsorventes, como o AST-120, visam impedir a absorção intestinal das toxinas urêmicas, permitindo a redução da produção de EROs, do estresse oxidativo e da inflamação (Kim; Song, 2020).
Os prebióticos, simbióticos e probióticos desempenham papéis cruciais no estímulo da proliferação de bactérias colônicas selecionadas. Estudos mostram que o uso de prebióticos está associado à redução da concentração sérica de toxinas urêmicas em humanos, ao diminuir a população de bactérias proteolíticas, promover a proliferação das sacarolíticas e a absorção de nutrientes. Em gatos, o emprego de prebióticos, como os beta-glucanos, levou a diminuição dos níveis urinários de IS e séricos de pCS, sugerindo a melhora na função da microbiota, da permeabilidade intestinal e da função renal (Hall; Jewell; Ephraim, 2022).
Os probióticos possibilitam a redução da uremia e restauração do equilíbrio da microbiota. Eles atuam como imunomoduladores, elevam a integridade da mucosa intestinal ou produzem AMPs, que impedem a adesão de microrganismos patogênicos. Enquanto os simbióticos têm sido associados à diminuição da progressão da DRC e à melhora da microbiota (Hall; Jewell; Ephraim, 2022).
Os SCFAs, como o butirato, propionato e acetato, desempenham um papel crucial na integridade da barreira epitelial, inibindo a proliferação de microrganismos patogênicos e exibindo propriedades anti-inflamatórias. Eles reduzem a infiltração de células imunes, a apoptose de células renais e estimulam a via autofágica, resultando na manutenção da barreira intestinal e na melhora da função renal (Andrade-Oliveira et al., 2015; Huang et al., 2017; Stavropoulou et al., 2020). Estudos, como o realizado por Andrade-Oliveira et al. (2015), demonstraram que camundongos submetidos à lesão renal por isquemia e reperfusão e tratados com probióticos contendo bactérias produtoras de acetato apresentaram diminuição significativa nos níveis séricos de ureia e creatinina, bem como na produção de mediadores inflamatórios e EROs, indicando um efeito protetor do tecido renal.
Considerações finais
A disbiose intestinal está associada ao maior predomínio de grupos bacterianos produtores de toxinas urêmicas, como IS e pCS, que atuam na progressão da DRC, exacerbando processos inflamatórios e induzindo danos no tecido renal. A constipação, comum na DRC, também contribui para o aumento da absorção de toxinas urêmicas, exacerbando os efeitos negativos sobre a função renal. Além disso, a restrição dietética necessária para o manejo da DRC pode influenciar a composição e função da microbiota, impactando a progressão da doença.
Diante disso, estratégias terapêuticas que visam modular a microbiota intestinal, como o uso de prebióticos, probióticos, simbióticos e adsorventes, demonstraram ser promissoras no tratamento da DRC. Elas favorecem a proliferação de bactérias benéficas, a produção de SCFAs, a integridade da barreira intestinal e exercem efeitos anti-inflamatórios e antioxidantes, contribuindo para a melhora da função renal, redução da uremia e a diminuição da progressão da DRC.
Referências
ANDRADE-OLIVEIRA, V.; AMANO, M. T.; CORREA-COSTA, M.; CASTOLDI, A.; FELIZARDO, R. J. F.; DE ALMEIDA, D. C.; BASSI, E. J.; MORAES-VIEIRA, P. M.; HIYANE, M. I.; RODAS, A. C. D.; PERON, J. P. S.; AGUIAR, C. F.; REIS, M. A.;
RIBEIRO, W. R.; VALDUGA, C. J.; CURI, R.; VINOLO, M. A. R.; FERREIRA, C.
M.; CÂMARA, N. O. S. Gut bacteria products prevent AKI induced by ischemia-reperfusion. Journal of the American Society of Nephrology, v. 26, n. 8, p. 1877–1888, 1 ago. 2015. Disponível em:
<https://journals.lww.com/jasn/fulltext/2015/08000/gut_bacteria_products_prevent_ aki_induced_by.16.aspx>. Acesso em: 9 fev. 2024.
BENJAMIN, S. E.; DROBATZ, K. J. Retrospective evaluation of risk factors and treatment outcome predictors in cats presenting to the emergency room for constipation. Journal of Feline Medicine and Surgery, v. 22, n. 2, p. 153–160, 1 fev. 2020. Disponível em:
<https://journals.sagepub.com/doi/10.1177/1098612X19832663?url_ver=Z39.88-2 003&rfr_id=ori%3Arid%3Acrossref.org&rfr_dat=cr_pub++0pubmed>. Acesso em: 10 fev. 2024.
CHENG, F. P.; HSIEH, M. J.; CHOU, C. C.; HSU, W. L.; LEE, Y. J. Detection of
indoxyl sulfate levels in dogs and cats suffering from naturally occurring kidney diseases. The Veterinary Journal, v. 205, n. 3, p. 399–403, 1 set. 2015. . Acesso
em: 15 fev. 2024.
CUNHA, R. S.; STINGHEN, A. E. M. The intricate relationship between gut and kidneyJornal brasileiro de nefrologia : ’orgao oficial de Sociedades Brasileira e Latino-Americana de NefrologiaNLM (Medline), 1 jul. 2018.
GLASSOCK, R. J.; MASSRY, S. G. Uremic toxins: an integrated overview of classification and pathobiology. Nutritional Management of Renal Disease, Fourth Edition, p. 77–89, 1 jan. 2022. . Acesso em: 11 fev. 2024.
HALL, J. A.; JEWELL, D. E.; EPHRAIM, E. Feeding cats with chronic kidney disease food supplemented with betaine and prebiotics increases total body mass and reduces uremic toxins. PLOS ONE, v. 17, n. 5, p. e0268624, 1 maio 2022. Disponível em:
<https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0268624>. Acesso em: 10 fev. 2024.
HUANG, W.; ZHOU, L.; GUO, H.; XU, Y.; XU, Y. The role of short-chain fatty acids in kidney injury induced by gut-derived inflammatory response. Metabolism, v. 68,
- 20–30, 1 mar. 2017. . Acesso em: 9 fev. 2024.
- JONES, S. E.; QUIMBY, J. M.; SUMMERS, S. C.; ADAMS, S. M.; CANEY, S. M.
A.; RUDINSKY, A. J. Survey of defecation habits in apparently healthy and chronic kidney disease cats. Journal of feline medicine and surgery, v. 24, n. 2, p. 131–141, 1 fev. 2022. Disponível em:
<https://pubmed.ncbi.nlm.nih.gov/34013812/>. Acesso em: 10 fev. 2024.
KIM, S. M.; SONG, I. H. The clinical impact of gut microbiota in chronic kidney disease. Korean Journal of Internal Medicine, v. 35, n. 6, p. 1305–1316, 2020.
LAMBERT, K.; RINNINELLA, E.; BIRUETE, A.; SUMIDA, K.; STANFORD, J.; RAOUL, P.; MELE, M. C.; WANG, A. Y. M.; MAFRA, D. Targeting the Gut
Microbiota in Kidney Disease: The Future in Renal Nutrition and Metabolism. Journal of Renal Nutrition, v. 33, n. 6, p. S30–S39, 1 nov. 2023. . Acesso em: 15 fev. 2024.
NALLU, A.; SHARMA, S.; RAMEZANI, A.; MURALIDHARAN, J.; RAJ, D. Gut
microbiome in chronic kidney disease: challenges and opportunities.
Translational Research, v. 179, p. 24–37, 1 jan. 2017. . Acesso em: 11 fev. 2024.
RAMOS, C. I.; ARMANI, R. G.; CANZIANI, M. E.; RIBEIRO DOLENGA, C. J.;
NAKAO, L. S.; CAMPBELL, K. L.; CUPPARI, L. Bowel Habits and the Association With Uremic Toxins in Non–Dialysis-Dependent Chronic Kidney Disease Patients. Journal of Renal Nutrition, v. 30, n. 1, p. 31–35, 1 jan. 2020.
STAVROPOULOU, E.; KANTARTZI, K.; TSIGALOU, C.; KONSTANTINIDIS, T.; ROMANIDOU, G.; VOIDAROU, C.; BEZIRTZOGLOU, E. Focus on the
Gut–Kidney Axis in Health and Disease. Frontiers in Medicine, v. 7, p. 620102,
21 jan. 2020. Disponível em: </pmc/articles/PMC7859267/>. Acesso em: 9 fev. 2024.
SUMMERS, S. C.; QUIMBY, J. M.; ISAIAH, A.; SUCHODOLSKI, J. S.;
LUNGHOFER, P. J.; GUSTAFSON, D. L. The fecal microbiome and serum concentrations of indoxyl sulfate and p-cresol sulfate in cats with chronic kidney disease. Journal of Veterinary Internal Medicine, v. 33, n. 2, p. 662–669, 1 mar. 2019. Disponível em: <https://onlinelibrary.wiley.com/doi/full/10.1111/jvim.15389>. Acesso em: 6 fev. 2024.
VAZIRI, N. D.; WONG, J.; PAHL, M.; PICENO, Y. M.; YUAN, J.; DESANTIS, T. Z.;
NI, Z.; NGUYEN, T.-H.; ANDERSEN, G. L. Chronic kidney disease alters intestinal microbial flora. Kidney International, v. 83, p. 308–315, 2013. Disponível em:
<http://www.kidney-international.org>. Acesso em: 11 fev. 2024.
WEHEDY, E.; SHATAT, I. F.; AL KHODOR, S. The Human Microbiome in Chronic Kidney Disease: A Double-Edged Sword. Frontiers in Medicine, v. 8, p. 790783, 17 jan. 2022. . Acesso em: 9 fev. 2024.





