

Orientador(a): Liliana Borges de Menezes Leite
Instituição: Universidade Federal de Goias
Trabalho Classificado na 10ª Edição (2024) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A seguinte revisão propõe uma análise através de um aspecto celular acerca das vias de sinalização associadas ao ganho de peso e seus efeitos pró e antiobesidade em experimentos realizados em cobaias, cuja finalidade é apresentar uma possível correlação que se torne aplicável a cães e gatos para obtenção de novas formulações dietéticas e terapêuticas para obtenção do ganho de peso adequado as espécies.
Palavras-chave: Tecido adiposo, cães, gatos, obesidade, experimentação animal.
Introdução
A obesidade em pequenos animais já é considerada uma epidemia moderna, sendo o distúrbio nutricional mais comum em cães e gatos, resultado do excesso crônico de ingestão de energia nos alimentos em relação ao reduzido gasto energético. As causas são multifatoriais e associam-se a alterações no tecido adiposo, alterações hormonais, alterações metabólicas e imunológicas (Kipperman & German, 2018). Diferente da medicina humana, cuja problemática da obesidade já e difundida na comunidade, a obesidade foi classificada tardiamente como doença pela Associação Mundial de Veterinários de Pequenos Animais (World Small Animal Veterinary Association One Heatlh – WSAVA) no ano de 2017, considerando a obesidade como sendo um dos maiores desafios do século XXI, resultando em diminuição da expectativa de vida em animais (German et al., 2018).
O estresse crônico da célula, induzida pela alimentação em excesso, proporciona balanço energético positivo, onde o consumo excede o gasto, com reserva lipídica estocada sob forma de triglicerídeos implicando em vários efeitos deletérios, induzindo a uma condição de inflamação crônica no tecido adiposo branco, permitindo assim que o adipócito se expanda, sofra um estresse mecânico quando em contato com células vizinhas, gerando hipóxia, aumentando a lipólise e remodelando a matriz extracelular (Salt et al., 2019).
O processo inflamatório induzido pela obesidade difere da “inflamação tradicional”. Hotamisligil (2017) caracteriza a inflamação no tecido adiposo como sendo “crônico de baixo grau”, apresentando alterações significativas nos fatores inflamatórios séricos que se encontram aumentados, como na interleucina-1 (IL-1), fator de necrose tumoral alfa (TNF- α), lectina do tipo C e no fator anti-inflamatório adiponectina, intensificando o processo de necrose da célula adipócita.
Desenvolvimento
Vias de sinalização da obesidade
- Via MAPK
Um mecanismo de sinalização celular, muito estudado e de importância nas condições de obesidade é denominado Mitogen Actived Protein Kinases (MAPK), que traduzindo refere-se à proteína quinase por mitógenos. É uma subfamília de proteínas quinase específicas de serina/treonina que responde a estímulos extracelulares que, quando ativados, desempenham uma via de cascata de sinais, fosforilando, e tem seu resíduo final serina e treorina (Dias, B, 2019). Em estudos da via de sinalização na reação oxidativa em ratos experimentais, foi possível observar três quinases ativadas sequencialmente: MAPK quinase quinase (Proteína quinase regulada por sinal extracelular ERK1/2), MAPK quinase (Quinase N-terminal c-Jun [JNK] ) e MAPK (p- 38), as quais, sob ação da proteína ativadora, transferem sinais ao núcleo do adipócito, monitorando o crescimento regular e sua diferenciação, que acontece tanto em processos fisiológicos como patológicos, uma vez que esse mecanismo consegue se adaptar ao estresse ambiental e respostas inflamatórias (LU, et al., 2019).
A via de sinalização P38 geralmente é ativada quando em condições de estresse/injúria celular. Um estudo realizado em camundongos diabéticos foi possível observar a ativação da mesma no fígado e músculo esquelético, ocorrendo o desenvolvimento de um processo de inflamação e apoptose, remodelando o tecido adiposo (Zhang, 2011). Segundo Dias B. (2019), a arginase II, ativa a p38 MAPK promovendo a sinalização de IL-6 no tecido adiposo, promovendo uma inibição direcionada ajudando a reduzir a inflamação do tecido adiposo branco e remodelação. A via de sinalização JNK, amplamente expressa no tecido adiposo de pacientes obesos, apresenta-se de maneira intensa nos processos de apoptose de fibroblastos (LU HD et al., 2019). A regulação do apetite mediada por MAPK contribui diretamente para a patogênese da obesidade. A ERK1/2 aumenta a expressão da pró- opiomelanocortina (POMC), estimulada pela glicose nos neurônios do hipotálamo, participa diretamente da ação anorexígena, efeito da leptina em neurônio AgrRP responsável pelo centro de saciedade e fome (Vemia, 2016). A inibição da ERK pode diminuir a ingestão de alimentos e aumento ao gasto energético, principalmente pelo bloqueio do feedback negativo do eixo hipotálamo-hipófise-tireoide e interrupção da comunicação de JNK1 e JNK2 na hipófise, o que reduz a expressão de iodotironina deiodinase tipo II (Dio2), bloqueando a termorregulação adaptativa mediada pela tiroxina, responsável pela gênese do acúmulo de lipídeos no adipócito, como descrito nos estudos de Watanabe (2019) com camundongos.
Ao desfosforilar e desativar as MAPK, a enzima fosfatase 9 restaura os níveis de fosforilação da tirosina do substrato-1 do receptor de insulina (IRS1) e sua capacidade de mediar a transdução do sinal da insulina (Khoubal, 2021). A inibição da MAPKs diminui infiltrado inflamatório, melhora tolerância a glicose e aumenta o número de adipócitos (Zeng, 2018), sendo uma excelente via para estudos clínicos para desenvolver estratégias para tratamento da obesidade.
- Via PI3/AKT
A via de sinalização fosfatidilinositol 3-quinase (PI3K)/AKT é ativada por hormônios e fatores de crescimento. A P3K converte em fosfatidilinositol 4,5 bifosfato (PIP2) em fosfatidilino-sitol 3,4,5-trifosfato (PIP3), ativando quinases dependentes de fosfoinositídeo e AKT. Além disso ele consegue regular os níveis de glicogênio e captação da glicose na adipogênese devido ação da glicogênio sintase quinase (GSK3) (Lee K, 2013). A leptina atua, via sistema nervoso central, pela mesma via PI3K/AKT suprimindo parcialmente a ingestão de alimentos, sendo assim a inibição seletiva da PIK3 sessa o efeito da leptina (Akalestou, 2020).
A inibição da PI3K/AKT leva a degradação do Sort1, elemento das vesículas de armazenamento do transportador de glicose 4 (GLUT4), diminuindo assim a sensibilidade a insulina (Zhang, 2011). A PI3K desempenha papel na termogênese, a alimentação com HFD (alimentação de alta caloria) induz a expressão da proteína de sinalização denominada Gab2 nos adipócitos, que quando deletado aumenta a expressão da proteína desacopladora 1 (UCP1) e outros genes do tecido adiposo marrom, atenuando o ganho de peso por meio da regulação negativa da via de sinalização PI3K-AKT-FoxO1 (Wang, et al., 2021).
- Via JAK
A via Janus quinase (JAK), transdutor de sinal e ativador de transcrição (STAT) se relaciona com a melanocortina, durante a sinalização do receptor de leptina (LEPR) ocorre a ativação do JAK2 ocasionando sua fosforilação que logo se liga ao SAT3 e SAT5 funcionando como fatores de transcrição (Li et al., 1999). Essa ativação tem participação no controle da ingestão alimentar e induz a expressão de citocina 3 que inibe o feedback da via de sinalização de leptina. A ligação que ocorre entre a LEPR e a leptina ativa a Rho-quinase tipo 1 que após sua fosforilação ativa Jak2 com o domínio de homologia scr2 (SH2), assim ativando a via PIK3 mediada por IRS1 e IRS2, ambas vias que levam a captação de glicose e aumento da síntese proteica e lipogênica e o que favorece ao surgimento da obesidade. Logo em seguida, ocorre uma transcrição da Pró-opiomelanocortina (POMC), aumentando a expressão de carboxipeptidase em hormônio estimulador de alfa melanócito (α-MSH) que por fim suprime a ingestão alimentar, definindo assim que a supressão da via JAK/STAT no SNC diminui a sensibilidade da leptina nos neurônios (Zhang, 2011).
- Via TGF – β
A superfamília das TGF – β apresenta importante papel na regulação metabólica, principalmente com os lipídeos e homeostase da glicemia sanguínea. Participam dessa família um grupo de fatores de diferenciação de crescimento (GDF´s), miostatina e BMPS, activinas/inibinas e TGF – β 1-3 (Zamani, 2011).
O GDF 15 é um importante regulador celular e vem sendo utilizado como potente indicador na terapia medicamentosa para o tratamento da obesidade. Camundongos com deficiência em GDF 15 apresentam uma resposta aversiva ao paladar, sugerindo assim que a mesma participa no metabolismo energético (Patel, 2019). A mecânica celular envolvida apresenta uma interação direta entre o receptor da família do fator neurotrófico derivado da linha celular glial (GDNF) da família de receptores do tipo “α- like” (GFRAL), expresso no SNC, diminuem a atividade simpato vagal e retarda o esvaziamento gástrico. Além disso, um efeito na lipólise do tecido adiposo é perceptível devido à expressão de adrenoceptor do tipo β 3 em ambos tecidos adiposos branco ou marrom, resultando na diminuição da massa de tecido adiposo (Patel, 2019).
A proteína morfogênica óssea (BMP4) é secretada por pré-adipócitos e conduz um fenótipo adiposo marrom em células pré-adipocitas. A expressão da BMP4 provoca a mudança do perfil de cor do tecido adiposo a apresentar-se marrom, levando a uma redução na adiposidade e alterações metabólicas relacionadas. Este processo por sua vez pode ser inibido pelo Gremiin-1, que é um antagonista celular da BMP, que juntos realizam uma cascata de sinalização, promovendo um feedback para controle e comprometimento a diferenciação adipogênica (Patel, 2019). Em estudos adicionais há uma sugestão particular referente a BMP7 que apresentam efeitos semelhantes a BMP4, onde na fase de diferenciação ocorre a indução a mudança de adipócitos do tipo marrom para o branco, sugerindo assim que as BMPS não são dependentes de seus próprios níveis, mas também dos níveis de antagonistas celulares presentes na célula (Gustafson, 2015).
- Via Wnt/ β – catenina
A via WNT/ β – catenina é uma via crônica de sinalização, composta por proteínas Wnt, Frizzled e LRP5/6, GSK3 e β – catenina. O processo de ativação e inibição da via Wnt leva a diferentes efeitos na obesidade por induzir a osteoclastogênese, suprimindo a expressão genética relacionada aos adipócitos, incluindo ácidos graxo sintase, e, assim, inibem a adipogênese (Gustafson, 2015). A sinalização da Wnt apresenta uma relação aos níveis do hormônio de leptina por suprimir os efeitos da glicogênio sintase quinase 3 β, um inibidor da sinalização de insulina, além da relação junto ao peso corporal, por diminuir o acúmulo de gordura e aumento do gasto energético por diminuir a intensidade das cores dos adipócitos (Sep, 2022).
A inativação da proteína 2 de ligação oxisterol (OSBPL2), que desempenha função de transporte das β – cateninas, promovem a maturação de pré-adipócitos e causam um efeito direto na obesidade. Quando a sinalização Wnt é ativada por células progenitoras adiposas, os camundongos apresentam redução significativa da gordura visceral e um maior grau de fibrose do tecido adiposo marrom, predispondo ao aumento de tecido adiposo branco, que é o mais comum na obesidade (Zeye, 2012).
Via AMPK
A via AMPK (proteína quinase ativada) é formada por subunidades catalíticas α1 e α2 e duas subunidades β1 e β2 e γ1 e γ2, funcionando como um medidor do estado de energia da célula (Sep, 2022). A ativação da AMPK no SNC resulta em ganho de peso por regular o comportamento alimentar, pela participação da leptina. Segundo os estudos de Dias et al.(2019), a administração de leptina em camundongos diminuiu a atividade da AMPK hipotalâmica reduzindo a ingestão de alimentos, enquanto a administração de grelina, estimulou a atividade da AMPK hipotalâmica e aumentou a ingestão de alimentos. A ativação da via AMPK nos adipócitos resulta na perda de peso por ativarem adipócitos marrons aumentando a via termogênica, melhorando inclusive a atividade da insulina (Wang, 2019).
A figura 1 exemplifica de maneira resumida, as vias de sinalização e seus efeitos anti-obesidade e pró obesidade: Saciedade, ou também diminuição no consumo de alimento; Ativação de processos metabólicos; Modificação no tecido adiposo desde aumento do número e tamanho celular, quanto ativação da cascata de inflação; Efeito sistêmico na resistência a insulina.
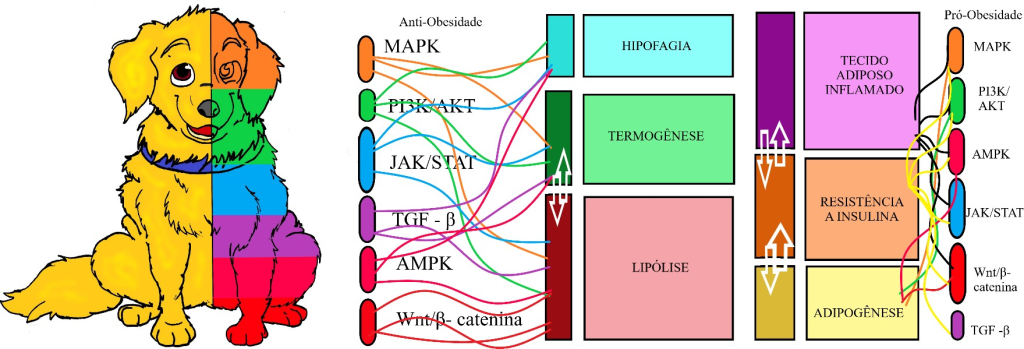
Considerações finais
Os estudos que envolvem obesidade trazem resultados satisfatórios para entender a gênese da condição. Embora o progresso e compreensão da etiologia e fisiopatologia já seja amplamente difundida na comunidade científica, ainda não são 100% satisfatórias. A descodificação das vias de sinalização, passa a apresentar relevância para a comunidade científica, explorando essa ferramenta, pode-se obter respostas que se aplicariam ao status nutricional de cães e gatos, propondo assim, novas tecnologias medicamentosas e principalmente alimentar que comprovados seus efeitos em tais vias, poderiam impactar não apenas na redução do ganho de peso, quanto também na melhoria do dos quadros de desnutrição e resistência a insulina em pequenos animais
Referências bibliográficas
Akalestou, E.; Genser, L.; Rutter, G.A. Glucocorticoid Metabolism in Obesity and Following Weight Loss. Frontiers in Endocrinology, 11: 1-9, 2020.
Dias, Ingrid Rayssa Souza Baliza. Papel das vias de sinalização MAPK(INK P38 e ERK1/2) e P53 na apoptose induzida por complexo de rutênio com papilartina em células de carcinoma de cólon humano. Instituto Gonçalo Muniz, Fio Cruz, Salvador, BA. 2019.
German, A. J.; Hervera, M.; Hunter, L.; Holdens , S.L.; Morris, P.J.; Biourge, V.; Trayinhunp, P. Improvement in insulin resistance and reduction in plasma inflammatory adipokines after weight loss in obese dogs. Domestic Animal Endocrinology, v.37, p.214–226, 2009.
Gustafson, B. et al. BMP4 and BMP antagonists regulate human white and beige adipogenesis. Diabetes 64, 1670–1681 (2015).
Hotamisligil, G, S. Inflamação, metainflamação e distúrbios imunometabólicos. Nature. 2017; 542 (7640) pag. 177-185.
Kipperman, B.S.; German, A.J. The Responsibility of Veterinarians to Address Companion Animal Obesity. Animals (Basel), 8(9): 143, 2018.
Khoubai, FZ et al. DUSP9, uma fosfatase de dupla especificidade com papel fundamental na biologia celular e em doenças humanas. Internacional J. Mol. Ciência. 22, 11538 (2021).
Lee, K. et al. Requisito de rictor na homeostase e função de células B madura no sangue, 122, 2369-2379 (2013)
Li S. Gao H, Hasegway Y. Luta contra remodelação no tecido adiposo. Sou J Phisiologu Endrocrinology Metab. 2021; 321, p 169-175.
Li, C et Al. Ativação do receptor de leptina no domínio SH2 contendo proteína tirosina fosfatase 2 modulando a transdução do receptor. Acad Nacional. Ciência. EUA, 96, 9677-9682 (1999)
Lu hd, Liu zc, Zhou Ly et al. Influencia do p38MAPK mediado por TLR4, via de sinalização na reação oxidativa em ratos experimentais, induzida por hipóxia intermitente com estresse e citocinas inflamatórias. Eu Ver Med Pharmacol Sciency. 2019; 23(1): 352-360
Lund, E. M. et al. Prevalence and risk factors for obesity in adult cats from provate US veterinat practives. InternJ Applied Research Vet Med, v.3, n.2. p. 88-96, 2005.
Patel, S. et al. GDF15 provides an endocrine signal of nutritional stress in mice and humans. Cell Metab. 29, 707–718.e708 (2019).
Salt, C. et al. Comparison of growth patterns in healthy dogs and dogs in abnormal body condition using growth standards. PloS One, 15(9): e0238521, 2020.
Sep, S. H. et al. Inhibition of CXXC5 function reverses obesity-related metabolic diseases. Clin. Transl. Med. 12, e742 (2022).
Wang Yang, Kong Min, Song Xiaoyu et al. Efeitos da berberina na fibrose do tecido adiposo e bactérias em ratos obesos. Pesquisa sobre efeitos regulatórios de grupos. Food Research and Development, 2019, 40(20):201- 206.
Wang, X. et al. A deficiência de Gab2 suprime a obesidade induzida por dieta rica em gordura, reduzindo a inflamação do tecido adiposo e aumentando a função adiposa marrom em camundongos. Morte Celular Dis. 12, 212 (2021).
Watanabe Y, Nagai Y, Honda H, et al. Isoliquiritigenina atenua o tecido adiposo por inibição da resposta imunológica em ratos. 6:23097. 2019
Zamani, N. et al. Emerging roles for the transforming growth factor-{beta} superfamily in regulating adiposity and energy expenditure. Endocr. Rev. 32, 387–403 (2011).
Zeng, X. et al. A função essencial do CARD9 na inflamação induzida pela dieta e distúrbios metabólicos em camundongos. J. Célula Mol. Med. 22, 2993– 3004 (2018).
Zhang X, Xu A, Chung sk, et a., Inativação seletiva de c-Jun NH2- quinase terminal no tecido adiposo protege contra obesidade induzida por dieta e melhora a sensibilidade a insulina no fígado e no musculo esquelético em camundongos diabéticos. 2011; 60(2): 486-495.
 br
br
 es
es
 en
en



