

Orientador(a): Ananda Portella Félix
Instituição: Universidade Federal do Paraná
Trabalho Classificado na 10ª Edição (2024) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
Diversos estudos têm demonstrado potenciais efeitos das beta- 1,3/1,6-glucanas sobre parâmetros imunológicos e de funcionalidade intestinal em cães, incluindo aumento das proporções de linfócitos, modulação da microbiota intestinal, redução da expressão de citocinas inflamatórias e aumento de IgA fecal. No entanto, devido à heterogeneidade nos estudos, que utilizam diferentes fontes, doses e metodologias, e à complexidade das interações entre o microbioma intestinal e o sistema imunológico, ainda existe dificuldade na reprodução consistente de resultados. Diante disso, esta revisão sistemática e meta-análise teve como objetivo avaliar os efeitos do consumo de beta-1,3/1,6-glucanas sobre parâmetros imunes e de funcionalidade intestinal em cães adultos saudáveis. Foram selecionados 12 artigos científicos publicados de 2007 a 2024 para a meta-análise, que foi conduzida utilizando o modelo de efeitos aleatórios com variância inversa, gerando uma estimativa combinada da diferença média padronizada entre os grupos controle, sem, e teste, com suplementação de beta-1,3/1,6-glucanas. Foi observada maior concentração de acetato, butirato e ácidos graxos de cadeia curta totais nas fezes dos cães alimentados com beta-1,3/1,6-glucanas (P<0,05). Ainda, houve tendência ao aumento na concentração fecal de propionato no grupo suplementado com beta-1,3/1,6-glucanas (P=0,08). Não houve diferença nas variáveis imunológicas avaliadas (P>0,05). Desse modo, conclui-se que o consumo de beta-1,3/1,6-glucanas aumenta a concentração fecal de produtos de fermentação intestinal considerados benéficos, indicando possível melhora da funcionalidade intestinal de cães.
PALAVRAS-CHAVE: canino, microbiota, imunidade, parede celular.
Introdução
A interrelação entre microbiota intestinal e sistema imunológico está no centro da fisiopatogenia de diversas doenças crônicas relatadas em cães e gatos (Honneffer; Minamoto; Suchodolski, 2014). Em razão disso, esses sistemas despertam o interesse de pesquisadores e nutricionistas, que buscam compreender os mecanismos pelos quais os ingredientes e aditivos podem trazer benefícios para a funcionalidade intestinal e seu impacto na saúde geral dessas espécies.
Nesse contexto, alguns polissacarídeos têm sido associados à modulação do sistema imunológico, possivelmente devido às interações entre a microbiota intestinal e o tecido linfoide associado ao intestino (GALT). Entre esses polissacarídeos, destacam-se as beta-glucanas, que são componentes estruturais encontrados em diversos organismos, como leveduras, fungos, algas marinhas, cogumelos e cereais (Kaur et al., 2019). Essas moléculas se distinguem pela sua estrutura físico-química (Mirończuk-Chodakowska; Kujawowicz; Witkowska, 202), exibindo diferentes respostas fisiológicas (Holscher, 2017).
Diversos estudos têm demonstrado os efeitos das beta-1,3/1,6-glucanas em cães, incluindo a modulação da microbiota intestinal (Bastos et al., 2023; Cho et al., 2022) e do sistema imunológico. Esses benefícios incluem aumento das proporções de linfócitos, redução da expressão de citocinas inflamatórias e contribuição para uma barreira intestinal eficaz, por meio do aumento de IgA na mucosa (Henríquez et al., 2023; Lin et al., 2020; Marchi et al., 2024).
Apesar do grande número de estudos utilizando beta-1,3/1,6-glucanas em cães, ainda existem dificuldades na predição dos principais efeitos dessas moléculas. Isso se deve à heterogeneidade nos estudos, que utilizam diferentes fontes, doses e metodologias. Além disso, é importante ressaltar a complexidade das interações entre o microbioma intestinal e o sistema imunológico, o que dificulta a reprodução consistente de resultados em diferentes contextos experimentais. Diante dessa diversidade, a realização de uma meta-análise é interessante, permitindo o agrupamento de resultados de diferentes estudos e a interpretação dos dados de forma mais crítica e acurada (Whitehead, 2002). Assim, o objetivo deste estudo foi conduzir uma revisão sistemática e meta-análise focada no consumo de beta-1,3/1,6-glucanas e seus efeitos sobre parâmetros de funcionalidade intestinal e resposta imunológica de cães adultos saudáveis.
Material e Métodos
A pesquisa de literatura foi conduzida em conformidade com as diretrizes do “Preferred Reporting Items for Systematic Review and Meta-Analysis Protocols – PRISMA-P” (Shamseer et al., 2015). Os termos utilizados foram pesquisados em inglês e incluíram: (“Beta-1,3/1,6-Glucans” OR “glucans” OR “glucan” OR “yeast cell wall”) AND (“dogs” OR “dog” OR “canine”). Apenas artigos científicos revisados por pares e publicados em inglês foram considerados, utilizando a base de dados Web of Science até 01 de fevereiro de 2024.
Todos os estudos foram revisados de forma independente por dois pesquisadores. Os estudos relevantes foram então selecionados para uma leitura detalhada do texto completo, a fim de identificar as publicações elegíveis. Quatro critérios de inclusão foram considerados para os estudos: 1) Ensaios randomizados controlados que comparavam um grupo controle, sem, e teste, tratado com beta-1,3/1,6-glucanas. Os estudos utilizaram cães adultos saudáveis, focando em parâmetros imunes e inflamatórios, além da composição e diversidade da microbiota intestinal e seus produtos de fermentação; 2) A seleção foi limitada a estudos que utilizaram fontes de beta- 1,3/1,6-glucanas, devidamente identificadas e que relataram a presença de beta-1,3/1,6-glucanas na fonte; 3) Foram considerados estudos em que as características do produto utilizado, composição das dietas, condições experimentais e de saúde dos animais foram bem descritas, fornecendo dados suficientes para calcular a diferença média (DM) e intervalo de confiança (IC) de 95%; 4) A inclusão foi baseada em estudos que apresentaram resultados quantitativos para pelo menos uma das variáveis de interesse.
Dois pesquisadores extraíram independentemente os dados dos estudos elegíveis, incluindo: sobrenome do primeiro autor, ano do estudo, delineamento, número de unidades experimentais e características dos animais, duração, descrição dos tratamentos, variáveis avaliadas e unidade de cada variável. Quando dois ou mais tratamentos similares foram avaliados em um estudo, os dados foram combinados como um grupo para análise, usando a calculadora RevMan. Os dados apresentados como mediana, valores mínimos e máximos ou distâncias interquartis foram transformados em média e desvio padrão, de acordo com MCGRATH et al. (2020). Um modelo de efeitos aleatórios com variância inversa foi utilizado para gerar uma estimativa combinada da diferença média padronizada (DMP) entre os grupos controle e dos cães tratados com beta-1,3/1,6-glucanas. Todos os cálculos e gráficos Forest plot foram realizados no software Review Manager – RevMan (RevMan, v. 5.4.1; Cochrane Collaboration). Os valores de P maiores que 0,05 e menores que 0,1 foram considerados tendência.
Resultados
Por meio da busca inicial no banco de dados, foram identificados 119 registros. Após remover os estudos inelegíveis, 12 estudos publicados entre 2007 e 2024 foram utilizados nessa revisão sistemática e meta-análise (Bastos et al., 2023; Beloshapka et al., 2012, 2013; Cho et al., 2022; Henríquez et al., 2023; Kroll et al., 2020; Lin et al., 2020; Marchi et al., 2024; Middelbos; Fastinger; Fahey, 2007; Rummell et al., 2022; Santos et al., 2022; Theodoro et al., 2019). As 12 publicações apresentaram um número total de 201 cães. Todos os estudos utilizaram como base dietas secas extrusadas, com exceção de um, em que os animais foram alimentados com dieta crua. As principais fontes de beta-1,3/1,6-glucanas foram: levedura de milho, cogumelo Hericium erinaceus, Saccharomyces cerevisiae desidratada, extrato de malte, parede celular de levedura hidrolisada e beta-1,3/1,6-glucanas purificadas extraídas de Saccharomyces cerevisiae. As doses e as principais informações dos estudos estão descritas na tabela 1.
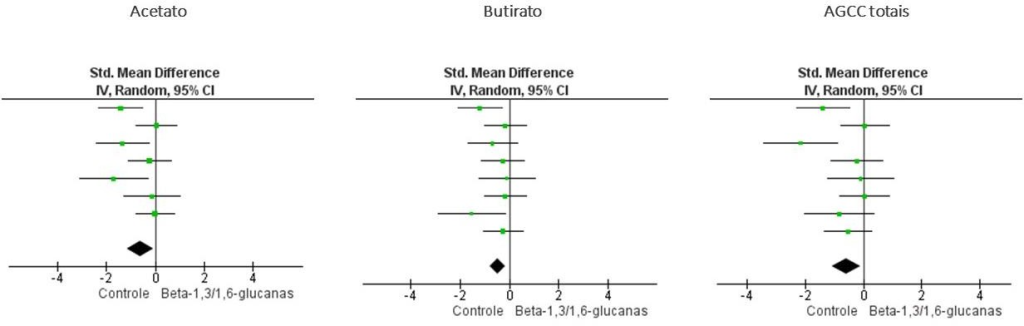
Foi observada maior concentração de acetato (DMP; 95% IC = − 0,60; − 1,44 – 0,06), butirato (DMP; 95% IC = − 0,47; − 0,80 – 0,14) e ácidos graxos de cadeia curta (AGCC) totais (DMP; 95% IC = − 0,18; − 0,52 – 0,17) nas fezes dos cães alimentados com beta-1,3/1,6-glucanas (P<0,05, figura 1). Ainda, houve tendência ao aumento na concentração fecal de propionato no grupo suplementado com beta-1,3/1,6-glucanas (DMP; 95% IC = − 0,34; − 0,72 – 0,04; P=0,08). Não houve efeito significativo do tratamento com beta-1,3/1,6- glucanas sobre as demais variáveis: ácidos graxos de cadeia ramificada totais (DMP; 95% IC = − 0,18; − 0,52 – 0,17; P=0,32), isovalerato (DMP; 95% IC = − 0,06; − 0,37 – 0,25; P=0,70), isobutirato (DMP; 95% IC = − 0,01; − 0,32 – 0,31; P=0,97), matéria seca fecal (DMP; 95% IC = − 0,06; − 0,36 – 0,48; P=0,77), amônia (DMP; 95% IC = − 0,09; − 0,46 – 0,29; P=0,63), igA fecal (DMP; 95% IC
= − 0,20; − 0,13 – 0,53), pH fecal (DMP; 95% IC = − 0,30; − 0,23 – 0,84;
P=0,26), Faecalibacterium (DMP; 95% IC = − 0,19; − 1,87 – 1,49; P=0,83),
Bacteroides (DMP; 95% IC = − 0,45; − 1,44 – 0,53; P=0,37), Prevotella (DMP; 95% IC = − 0,19; − 4,68 – 4,30; P=0,93), coeficiente de digestibilidade aparente da proteína bruta (DMP; 95% IC = − 0,05; − 0,59 – 0,69; P=0,88), relação linfócitos CD4+:CD8+ (DMP; 95% IC = − 0,08; − 1,03 – 0,88; P=0,87).
Tabela 1. Características dos estudos incluídos na meta-análise. |

Discussão
Por serem polissacarídeos não amiláceos, as beta-glucanas não são digeridas pelas enzimas endógenas dos mamíferos. Isso sugere que, teoricamente, estariam disponíveis para fermentação bacteriana no cólon, resultando na produção de AGCC (Zavadinack et al., 2024). Os resultados desta meta-análise sugeriram essa possibilidade, ao demonstrarem que o aumento da concentração fecal de AGCC, em especial acetato e butirato, podem ser efeitos do consumo de beta-1,3/1,6-glucanas.
Diversos estudos em cães demonstram que as concentrações fecais aumentadas de AGCC como butirato e propionato, por exemplo, são indicativos de eubiose (Félix; Souza; de Oliveira, 2022; Pilla; Suchodolski, 2020). Isso se deve às ações desses metabólitos, que incluem a redução do pH do meio e o fornecimento de energia para os colonócitos. Essa acidificação do lúmen é importante, uma vez que limita o crescimento de certas espécies bacterianas com potencial patogênico e favorece o crescimento de bactérias relacionadas à eubiose (Barko et al., 2018). Essa melhoria no ambiente intestinal também está associada às propriedades anti-inflamatórias do butirato e do propionato. Esses metabólitos promovem a regulação negativa de receptores transmembranares específicos, como o Toll-like 4, e a supressão da via de sinalização do NF-κB (Chen; Vitetta, 2018; Liu et al., 2017), resultando na inibição da produção de TNF-α, IL-6 e IL-12 em macrófagos (Lavelle; Sokol, 2020; Lee et al., 2017).
No entanto, é importante ressaltar que a capacidade fermentativa das beta-1,3/1,6-glucanas pode variar de acordo com sua fonte, características físico-químicas e método de obtenção (Zavadinack et al., 2024). Esse fato sugere que os mecanismos de ação envolvidos na modulação da microbiota e sistema imunológico por essas moléculas sejam mais complexos, podendo abranger outras vias além daquelas relacionadas aos produtos finais de fermentação bacteriana.
Há evidências de que antes de chegarem ao cólon, parte das beta- 1,3/1,6-glucanas possam ser absorvidas no intestino delgado, sendo reconhecidas pelos macrófagos, desencadeando uma resposta imune (Córdova-Martínez et al., 2021). Esse efeito imunomodulador já foi documentado em estudos envolvendo cães com enteropatia crônica, bem como em estudos com filhotes, nos quais as beta-1,3/1,6-glucanas foram utilizadas como “booster” vacinal (Paris et al., 2020; Rentas et al., 2020). Apesar disso, os estudos incluídos nessa meta-análise, quando analisados em conjunto, não demonstraram efeito em variáveis como a razão de linfócitos CD4+:CD8+ e IgA fecal. Esses parâmetros, respectivamente, são indicativos da eficiência do sistema imunológico e do aumento da imunidade de mucosa, e já foram associados ao consumo de beta-1,3/1,6-glucanas em cães (Lin et al., 2020; Marchi et al., 2024).
Não foram encontrados estudos suficientes para permitir uma comparação adequada do consumo de beta-1,3/1,6-glucanas sobre os índices de diversidade bacteriana, fenóis, indóis, valerato e outras variáveis, como perfil fagocitário, contagem de leucócitos, anticorpos vacinais e interleucinas. Essa impossibilidade de comparação se deve à falta de estudos, com menos de quatro publicações disponíveis analisando a mesma variável, ou a diferenças significativas nas metodologias entre os materiais disponíveis. Esse resultado destaca a necessidade de mais pesquisas padronizadas para melhor compreensão dos efeitos das beta-1,3/1,6-glucanas nas dietas para cães.
Conclusão
Há evidências significativas de que o consumo de beta-1,3/1,6-glucanas aumenta a concentração fecal de AGCC, como o acetato e o butirato, indicando possível melhora da funcionalidade intestinal de cães com o seu consumo.
Referências bibliográficas
BARKO, P. C. et al. The Gastrointestinal Microbiome: A Review. [S. l.: s. n.], 2018.
BASTOS, T. S. et al. Diet supplemented with Saccharomyces cerevisiae from different fermentation media modulates the faecal microbiota and the intestinal fermentative products in dogs. Journal of Animal Physiology and Animal Nutrition, [s. l.], v. 107, n. S1, p. 30–40, 2023. Disponível em: https://onlinelibrary.wiley.com/doi/10.1111/jpn.13824.
BELOSHAPKA, A. N. et al. Effects of inulin or yeast cell-wall extract on nutrient digestibility, fecal fermentative end-product concentrations, and blood metabolite concentrations in adult dogs fed raw meat–based diets. American Journal of Veterinary Research, [s. l.], v. 73, n. 7, p. 1016–1023, 2012. Disponível em: https://avmajournals.avma.org/view/journals/ajvr/73/7/ajvr.73.7.1016.xml.
BELOSHAPKA, A. N. et al. Fecal microbial communities of healthy adult dogs fed raw meat-based diets with or without inulin or yeast cell wall extracts as assessed by 454 pyrosequencing. FEMS Microbiology Ecology, [s. l.], v. 84, n. 3, p.532–541, 2013. Disponível em: https://academic.oup.com/femsec/article-lookup/doi/10.1111/1574-6941.12081.
CHEN, J.; VITETTA, L. Inflammation-Modulating Effect of Butyrate in the Prevention of Colon Cancer by Dietary Fiber. Clinical Colorectal Cancer, [s. l.], v. 17, n. 3, p. e541–e544, 2018. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S1533002818301397.
CHO, H. W. et al. Gut microbiota profiling in aged dogs after feeding pet food contained Hericium erinaceus. Journal of Animal Science and Technology, [s. l.], v. 64, n. 5, p. 937–949, 2022.
CÓRDOVA-MARTÍNEZ, A. et al. β-Glucans Could Be Adjuvants for SARS-CoV-2 Virus Vaccines (COVID-19). International Journal of Environmental Research and Public Health, [s. l.], v. 18, n. 23, p. 12636, 2021. Disponível em: https://www.mdpi.com/1660-4601/18/23/12636.
FÉLIX, A. P.; SOUZA, C. M. M.; DE OLIVEIRA, S. G. Biomarkers of gastrointestinal functionality in dogs: A systematic review and meta-analysis. Animal Feed Science and Technology, [s. l.], v. 283, p. 115183, 2022.
HENRÍQUEZ, L. B. F. et al. Effects of Malt Extract on Nutritional and Functional Aspects in Healthy Adult Dogs. Fermentation, [s. l.], v. 9, n. 10, 2023.
HOLSCHER, H. D. Dietary fiber and prebiotics and the gastrointestinal microbiota. Gut Microbes, [s. l.], v. 8, n. 2, p. 172–184, 2017. Disponível em: https://www.tandfonline.com/doi/full/10.1080/19490976.2017.1290756.
HONNEFFER, J. B.; MINAMOTO, Y.; SUCHODOLSKI, J. S. Microbiota alterations in acute and chronic gastrointestinal inflammation of cats and dogs. World Journal of Gastroenterology, [s. l.], v. 20, n. 44, p. 16489–16497, 2014.
KAUR, R. et al. Structural Features, Modification, and Functionalities of Beta- Glucan. Fibers, [s. l.], v. 8, n. 1, p. 1, 2019. Disponível em: https://www.mdpi.com/2079-6439/8/1/1.
KROLL, F. S. A. et al. Active fractions of mannoproteins derived from yeast cell wall stimulate innate and acquired immunity of adult and elderly dogs. Animal Feed Science and Technology, [s. l.], v. 261, p. 114392, 2020. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S0377840118315700.
LAVELLE, A.; SOKOL, H. Gut microbiota-derived metabolites as key actors in inflammatory bowel disease. Nature Reviews Gastroenterology & Hepatology, [s. l.], v. 17, n. 4, p. 223–237, 2020.
LEE, C. et al. Sodium butyrate inhibits the NF-kappa B signaling pathway and histone deacetylation, and attenuates experimental colitis in an IL-10 independent manner. International Immunopharmacology, [s. l.], v. 51, p. 47 56, 2017. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S1567576917302904.
LIN, C.-Y. et al. Supplementation of Yeast Cell Wall Fraction Tends to Improve Intestinal Health in Adult Dogs Undergoing an Abrupt Diet Transition. Frontiers in Veterinary Science, [s. l.], v. 7, 2020a. Disponível em: https://www.frontiersin.org/articles/10.3389/fvets.2020.597939/full.
LIN, C.-Y. et al. Supplementation of Yeast Cell Wall Fraction Tends to Improve Intestinal Health in Adult Dogs Undergoing an Abrupt Diet Transition. Frontiers in Veterinary Science, [s. l.], v. 7, 2020b.
LIU, T. et al. NF-κB signaling in inflammation. [S. l.]: Springer Nature, 2017. MARCHI, P. H. et al. Effects of Increasing Levels of Purified Beta-1,3/1,6- Glucans on the Fecal Microbiome, Digestibility, and Immunity Variables of Healthy Adult Dogs. Microorganisms, [s. l.], v. 12, n. 1, p. 113, 2024. Disponível em: https://www.mdpi.com/2076-2607/12/1/113.
MCGRATH, S. et al. Estimating the sample mean and standard deviation from commonly reported quantiles in meta-analysis. Statistical Methods in Medical Research, [s. l.], v. 29, n. 9, p. 2520–2537, 2020. Disponível em: http://journals.sagepub.com/doi/10.1177/0962280219889080.
MIDDELBOS, I. S.; FASTINGER, N. D.; FAHEY, G. C. Evaluation of fermentable oligosaccharides in diets fed to dogs in comparison to fiber standards. Journal of Animal Science, [s. l.], v. 85, n. 11, p. 3033–3044, 2007. Disponível em: https://academic.oup.com/jas/article/85/11/3033/4779189.
MIROŃCZUK-CHODAKOWSKA, I.; KUJAWOWICZ, K.; WITKOWSKA, A. M. Beta-Glucans from Fungi: Biological and Health-Promoting Potential in the COVID-19 Pandemic Era. Nutrients, [s. l.], v. 13, n. 11, p. 3960, 2021. Disponível em: https://www.mdpi.com/2072-6643/13/11/3960.
PARIS, S. et al. β-Glucan as Trained Immunity-Based Adjuvants for Rabies Vaccines in Dogs. Frontiers in Immunology, [s. l.], v. 11, 2020. Disponível em: https://www.frontiersin.org/article/10.3389/fimmu.2020.564497/full.
PILLA, R.; SUCHODOLSKI, J. S. The Role of the Canine Gut Microbiome and Metabolome in Health and Gastrointestinal Disease. [S. l.]: Frontiers Media S.A., 2020.
RENTAS, M. F. et al. Galactoligosaccharide and a prebiotic blend improve colonic health and immunity of adult dogs. PLOS ONE, [s. l.], v. 15, n. 8, p.e0238006, 2020.
RUMMELL, L. M. et al. A proof of principle study investigating the effects of supplemental concentrated brewer’s yeast on markers of gut permeability, inflammation, and fecal metabolites in healthy non-challenged adult sled dogs. Journal of Animal Science, [s. l.], v. 100, n. 11, p. 1–11, 2022.
SANTOS, K. de M. et al. Saccharomyces cerevisiae dehydrated culture modulates fecal microbiota and improves innate immunity of adult dogs. Fermentation, [s. l.], v. 8, n. 1, 2022.
SHAMSEER, L. et al. Preferred reporting items for systematic review and meta- analysis protocols (PRISMA-P) 2015: elaboration and explanation. BMJ, [s. l.],
- 349, n. jan02 1, p. g7647–g7647, 2015. Disponível em: https://www.bmj.com/lookup/doi/10.1136/bmj.g7647.
THEODORO, S. de S. et al. Effects of the solubility of yeast cell wall preparations on their potential prebiotic properties in dogs. PLOS ONE, [s. l.], v. 14, n. 11, p. e0225659, 2019. Disponível em: https://dx.plos.org/10.1371/journal.pone.0225659.
WHITEHEAD, A. Meta‐Analysis Of Controlled Clinical Trials. [S. l.]: Wiley,2002. Disponível em: https://onlinelibrary.wiley.com/doi/book/10.1002/0470854200.
ZAVADINACK, M. et al. (1 → 3),(1 → 6) and (1 → 3)-β-D-glucan physico- chemical features drive their fermentation profile by the human gut microbiota. Carbohydrate Polymers, [s. l.], v. 327, p. 121678, 2024. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S0144861723011438.
 br
br
 es
es
 en
en



