

Orientador(a): Márcio Antonio Brunetto
Instituição: FMVZ USP
Trabalho classificado na 9ª Edição (2023) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A análise de metabolômica sérica tem auxiliado na compreensão de fatores de risco dietéticos, patogênese e no tratamento de humanos diabéticos. Este estudo objetivou comparar o perfil metabolômico de cães diabéticos e saudáveis. Dez cães adultos saudáveis [grupo controle (GC)] de proprietários em dieta de manutenção (padronizada) e dez cães adultos diabéticos [grupo diabéticos(GD)] de proprietários, com quadro clínico estável, sem outras comorbidades, em dieta hipocalórica para manutenção (padronizada) e sob terapia com insulina (tipo NPH), foram incluídos. Os metabólitos séricos em jejum foram identificados nos espectros de Ressonância Magnética Nuclear (RMN) de 1H e analisados pela análise multivariada. Análises de componentes principais (PCA) foram realizadas para avaliar as diferenças entre os grupos e a análise discriminante por Quadrados Mínimos Parciais (PLS-DA) para discriminar e identificar os metabólitos que diferenciaram os grupos, utilizando-se pré-processamento de escala de Pareto para o conjunto de dados (53 observações × 236 variáveis). No PCA, o GC foi agrupado em PC1 e PC2 negativo, com exceção de dois animais, um deles fora do limite do intervalo de confiança de 95%. O GD agrupou-se no PC1 negativo, mas disseminou-se pelo PC2, exceto por dois animais com perfil metabólico mais semelhante ao CO. O gráfico de cargas do PC1 revelou que os metabólitos que influenciaram a separação no eixo 1 foram α- e β-glicose. Animais distribuídos em PC2 positivo apresentaram concentrações mais elevadas de glicose e lactato (GD). O gráfico de colunas para o eixo 1 do PLS-DA mostrou que a glicose foi o metabólito com maior concentração no GD, e este grupo também apresentou maiores concentrações de metabólitos lipídicos, lactato e aminoácidos de cadeia ramificada (AACR). Conclui-se que houve diferença no perfil metabolômico sérico entre cães diabéticos e saudáveis, de modo que foi observado maiores concentrações dos metabólitos: glicose, AACR, metabólitos lipídicos e lactato nos cães diabéticos.
Introdução
O diabetes mellitus (DM) é uma doença crônica, de etiologia multifatorial, que resulta em hiperglicemia como consequência da deficiência de insulina e, pode resultar em diversas complicações, incluindo coma e morte (FELDMAN, 2004). A análise metabolômica é de suma importância para a identificação de possíveis biomarcadores prognósticos envolvidos na patogênese de complicações diabéticas ou preditivos de futuras complicações diabéticas, como já demonstrado em humanos (ORESIC et al., 2008; GUASCH-FERRÉ et al., 2016; GAR et al., 2018), o que pode facilitar a tomada de decisão do médico veterinário e beneficiar pacientes em risco. Ademais, é fundamental a identificação de biomarcadores que indicam resposta clínica à terapia medicamentosa e nutricional, os quais auxiliam na identificação de indivíduos que podem se beneficiar da terapia, comparados a aqueles que não apresentam resposta. Nesse âmbito, devido à escassez de estudos com cães diabéticos, o presente estudo objetivou comparar o perfil metabolômico sérico de cães diabéticos e cães saudáveis.
Material e Métodos
Os procedimentos experimentais foram previamente aprovados pela Comissão de Ética no Uso de Animais (CEUA) da Instituição onde foi realizado o estudo (protocolo: 4668091214 e 7943060716).
Cães diabéticos
Os cães diabéticos utilizados no presente estudo foram selecionados da rotina clínica de um hospital veterinário escola, de uma universidade pública situada no estado de São Paulo. Foram adotados os seguintes critérios de inclusão: cães diagnosticados com DM, fêmeas (castradas) ou machos, com idade superior a um ano, sem outras doenças concomitantes, com escore de condição corporal (ECC) entre 4 e 6 em uma escala de 1 a 9 (LAFLAMME, 1997), ausência de terapia com outras drogas ou suplementos, por pelo menos seis meses.
Foram analisados prontuários de 572 cães diabéticos, dos quais 472 foram excluídos por motivos diversos, como presença de doenças concomitantes, impossibilidade de ir ao hospital veterinário, consumo de dieta caseira etc. Portanto, 10 cães estiveram aptos a participar do estudo e, inicialmente, passaram por um período de estabilização do DM. Neste período, todos os animais consumiram um alimento basal, o qual consistiu em um alimento comercial hipocalórico [3,2 Kcal/g de matéria seca (MS)]; com alto teor de fibra (19,6% na MS), alto teor de proteína (39,5% na MS), teores moderados de gordura (9,0% na MS) e amido (19,1% na MS). O cálculo da necessidade energética de manutenção (NEM) foi realizado através da fórmula: 95 x PC0,75 [PC = peso corporal; (NRC, 2006)]. Os proprietários foram instruídos a fornecer duas refeições diárias, com intervalo de 12 horas, e após cada refeição realizar a aplicação da insulina. A dose inicial de insulina (NPH) foi de 0,25U/kg de peso corporal, a cada 12 horas (RUCINSKY et al., 2010). Os animais foram avaliados a cada 15 dias para avaliação da necessidade de eventuais ajustes na dose de insulina e na quantidade de alimento. O quadro de DM foi considerado estabilizado de acordo com as seguintes observações: pelo menos 45 dias sem alterações na dosagem de insulina devido à ausência de manifestações de poliúria e polidipsia e, variação da glicemia entre 90 e 300 mg/dL.
Grupo controle
O grupo controle foi composto por dez cães saudáveis, com ECC 4-5/9 (LAFLAMME, 1997), selecionados após divulgação da pesquisa em redes sociais e entre universitários. Para confirmação da higidez dos animais, foi realizado exame clínico e os seguintes procedimentos: coleta de sangue para realização de leucograma e eritrograma, e perfil bioquímico. Após a triagem e seleção dos animais do grupo controle, a alimentação foi padronizada, de modo que todos passaram a consumir um alimento comercial seco extrusado (teores nutricionais e valor energético em MS: proteína bruta= 25,5%, gordura= 13,3%, amido= 49,4%, 4,2 Kcal/g), indicado para cães adultos em manutenção, durante 28 dias. O cálculo da NEM foi idêntico ao descrito anteriormente para os cães diabéticos, assim como também foram realizados ajustes quando necessário, para a manutenção do peso corporal.
Após estabilização do DM nos cães diabéticos e após padronização da dieta por 28 dias dos animais do grupo controle, foi realizada coleta de sangue pela manhã, com os animais em jejum, para separação do soro e posterior análise matabolômica sérica não direcionada. As amostras de soro ficaram armazenadas em criotubos a -80°C até o momento das análises.
Análise metabolômica não direcionada por ressonância magnética nuclear (RMN)
Todas as análises de RMN foram realizados a 300 K em um espectrômetro RMN Bruker AVANCE III HD 600, operando a 14,1 T, observando 1H a 600,13. Os espectros de 1H RMN (128 transientes e 32 K pontos de dados) foram adquiridos através do software ICON. Para aquisição de espectros 1D NOESY-presat, foram usados tempo de mistura de 100 ms, atraso de relaxamento de 2 s e 4 varreduras fictícias. Os espectros foram processados no software TopSpin3.5. Os metabólitos foram atribuídos com base nos deslocamentos químicos e multiplicidades de sinal, no software Chenomix.
Análise estatística
A análise multivariada dos espectros de 1H RMN das 20 amostras de soro foi realizada no software SIMCA-P (versão 16.0, Umetrics). Os espectros de amostra de 5 CQ foram incluídos no conjunto de dados para verificar a reprodutibilidade. A análise de componentes principais (PCA) e a análise discriminante por mínimos quadrados parciais (PLS-DA) foram realizadas por meio de pré-processamento de escala de Pareto para o conjunto de dados (53 observações × 236 variáveis).
Resultados
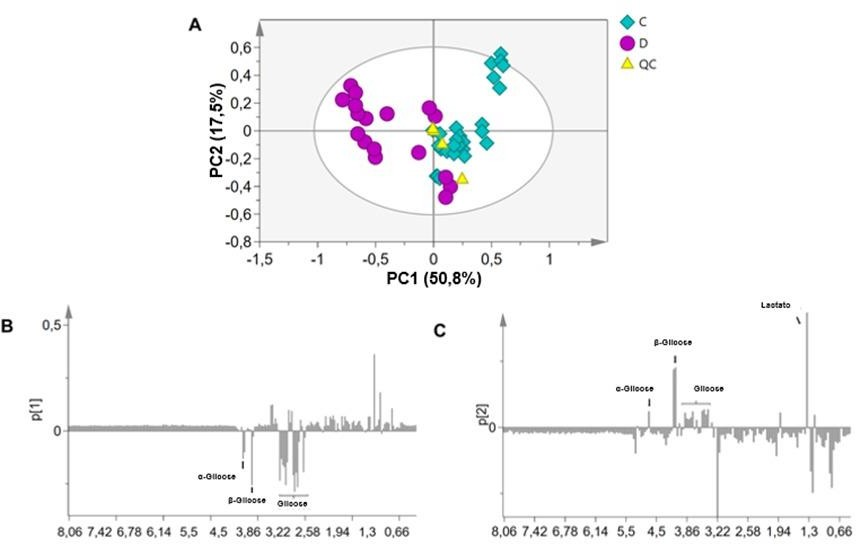
Os espectros 1D NOESY-presat 1H RMN representativos dos grupos de amostra estão ilustrados na Figura 1, com os metabólitos séricos identificados. O espectro dos animais saudáveis, na Figura 1A, ilustra as atribuições dos sinais de RMN do metabólito. As concentrações de alguns metabólitos principais é maior no grupo diabético (Figura 1B). A Figura 2A ilustra o gráfico de pontuação dos componentes principais (PC) 1 e 2. PC1 e PC2 representaram 68,2% da variação dos dados. A separação dos grupos se dá pelo componente 1 (PC1), pois os animais saudáveis apresentaram valores positivos e o grupo de cães diabéticos valores negativos. Na Figura 2B, pode-se observar que os metabólitos que influenciaram a separação no eixo 1 foram α- e β-glicose. Além disso, os animais distribuídos em PC2 positivo apresentaram concentrações mais elevadas de glicose e lactato, como ilustrado na Figura 2C.
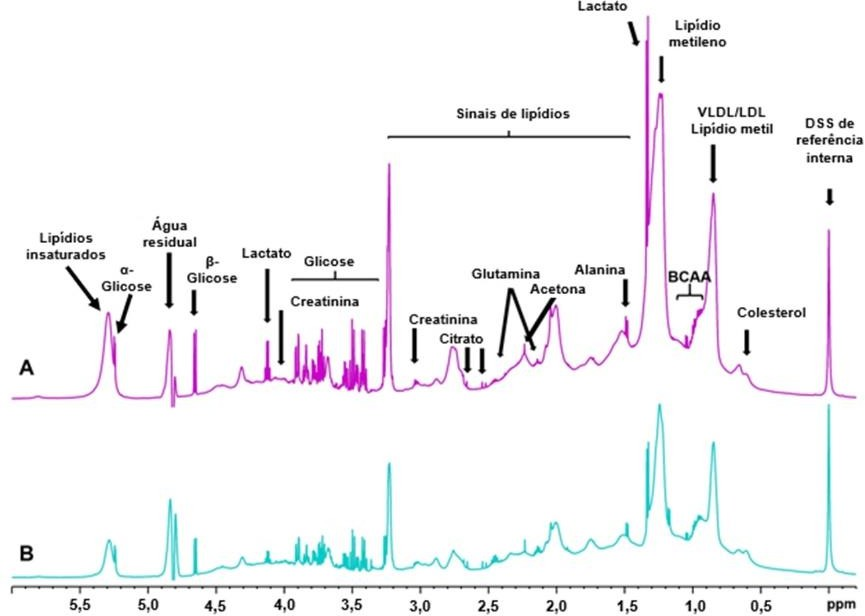
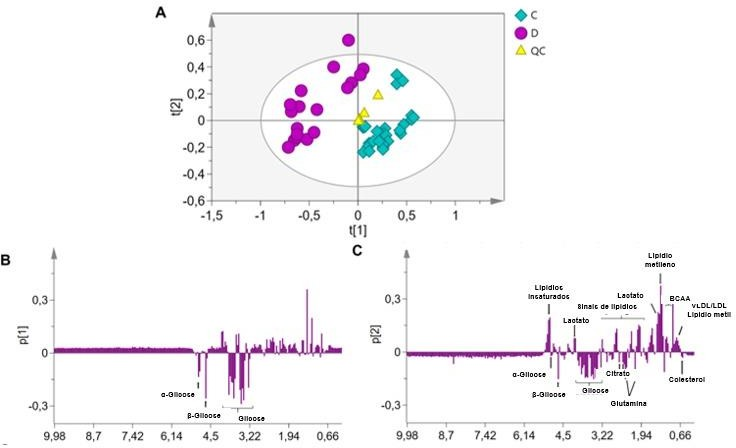
A Figura 3A ilustra que o modelo PLS-DA foi capaz de distinguir completamente os grupos. O Grupo de animais saudáveis foi agrupado no eixo positivo 1 e eixo negativo 2 no gráfico de dispersão das pontuações, exceto um animal posicionado no eixo positivo 2. Os animais diabéticos estavam concentrados no eixo negativo 1, mas distribuídos ao longo do eixo 2.
Um modelo PLS-DA (Figura 3) foi criado para discriminar os diferentes grupos e identificar os metabólitos que contribuíram significativamente para a classificação dos grupos. O gráfico de colunas (Figura 3B) para o eixo 1 do PLS- DA não forneceu informações diferentes do gráfico de PCA, pois a glicose foi o metabólito com maior concentração nos animais diabéticos. Por outro lado, na Figura 3C observa-se que os animais com PC2 positivo apresentaram concentrações mais elevadas de lipídios, lactato e AACR.
Discussão
O presente estudo é pioneiro na realização de análise metabolômica sérica não direcionada por RMN em cães diabéticos em jejum e comparação com cães saudáveis. Além disso, é o único estudo no qual houve padronização de dieta em ambos os grupos. Em suma, a análise metabolômica sérica apontou que o grupo de cães diabéticos apresentaram maiores concentrações dos metabólitos: glicose, lactato, AACR e metabólitos lipídicos; quando comparados ao grupo de cães saudáveis. No que se refere ao aumento de metabólitos lipídicos nos cães diabéticos, isso pode ser justificado pela ausência de insulina, a qual suprime a enzima lipase hormônio sensível (enzima envolvida na lipólise) e menor captação de glicose pelos tecidos insulino-dependentes, fatores que provocam contínua atividade de lipólise e redução da lipogênese, o que resulta em aumento dos metabólitos lipídicos circulantes (BEITZ, 2015; TEIXEIRA, 2020). A hiperlipidemia em cães diabéticos é frequente, inclusive há até relatos de aterosclerose em animais endocrinopatas (MAHLEY et al., 1977; LIU et al., 1986; KAGAWA et al., 1998; SOTTIAUX, 1999; HESS et al., 2003).
O lactato em jejum tem sido utilizado na medicina humana como um preditor prognóstico e, pode ser um indicador útil para doenças metabólicas (JONES et al., 2019). Em humanos obesos, com resistência insulínica (KRAUS et al. 2001) e em cães obesos (VENDRAMINI et al., 2020), já foi demonstrado aumento de lactato, associado a diminuição de oxidação completa de glicose no tecido muscular, o que pode provocar aumento compensatório da produção de lactato, através de metabolismo anaeróbico (KRAUS et al., 2001; JONES et al., 2019). Em indivíduos diabéticos, acredita-se que os mesmos mecanismos possam estar envolvidos no aumento de lactato. Em relação aos AACR, segundo Gar et al. (2018), eles são marcadores de pré-diabetes, resistência à insulina e preditor do desenvolvimento de DM tipo 2 em humanos. Em um comparativo a pacientes humanos com DM tipo 1, assim como observado no presente estudo, os AACR estavam elevados, mesmo em pacientes com bom controle glicêmico (DUTTA et al., 2016). Além disso, observou-se concentrações séricas aumentadas antes da soroconversão de autoanticorpos em crianças que posteriormente desenvolveram DM tipo 1 (ORESIC et al., 2008).
Conclusão
Conclui-se que houve diferença no perfil metabolômico sérico entre cães diabéticos e saudáveis, semelhante ao que já foi observado em seres humanos, inclusive de metabólitos considerados biomarcadores de risco e preditores prognósticos, como AACR e lactato. Esses achados sugerem potencial aplicação desses metabólitos como biomarcadores para o diagnóstico e tratamento do diabetes em cães. Estudos futuros são necessários para avaliar o potencial efeito de alimentos de prescrição para cães diabéticos, bem como do uso de nutracêuticos nas alterações observadas no perfil metabolômico.
Referências bibliográficas
BEITZ, D. C. Metabolismo lipídico. In: REECE, W. O. (Ed.). Dukes Fisiologia dos animais domésticos. 12. ed. Rio de Janeiro: Guanabara Koogan, 2015. p. 476– 492.
DUTTA, Tumpa et al. Impact of long-term poor and good glycemic control on metabolomics alterations in type 1 diabetic people. The Journal of Clinical Endocrinology & Metabolism, v. 101, n. 3, p. 1023-1033, 2016.
FELDMAN, E. C. Canine diabetes mellitus. Canine and feline endocrinology and reproduction, p. 486-538, 2004.
GAR, C. et al. Serum and plasma amino acids as markers of prediabetes, insulin resistance, and incident diabetes. Critical reviews in clinical laboratory sciences, v. 55, n. 1, p. 21-32, 2018.
GUASCH-FERRÉ, Marta et al. Metabolomics in prediabetes and diabetes: a systematic review and meta-analysis. Diabetes care, v. 39, n. 5, p. 833-846, 2016.
HESS, R. S.; KASS, P. H.; VAN WINKLE, T. J. Association between Diabetes Mellitus, Hypothyroidism or Hyperadrenocorticism, and Atherosclerosis in Dogs. Journal of Veterinary Internal Medicine, v. 17, n. 4, p. 489–494, 2003.
JONES, Terry E. et al. Plasma lactate as a marker of metabolic health: Implications of elevated lactate for impairment of aerobic metabolism in the metabolic syndrome. Surgery, v. 166, n. 5, p. 861-866, 2019.
KAGAWA, Y. et al. Systemic atherosclerosis in dogs: Histopathological and immunohistochemical studies of atherosclerotic lesions. Journal of Comparative Pathology, v. 118, n. 3, p. 195–206, 1998.
KRAUS, William E. et al. Studies of a targeted risk reduction intervention through defined exercise (STRRIDE). Medicine and Science in Sports and Exercise, v. 33, n. 10, p. 1774-1784, 2001.
LAFLAMME, D. P. Development and validation of a body condition score system for dogs. Canine Practice, v. 22, n. 4, p. 10–15, 1997.
LIU, S. K. et al. Clinical and pathologic findings in dogs with atherosclerosis: 21 cases (1970-1983). Journal of the American Veterinary Medical Association, v. 189, n. 2, p. 227–232, 1986.
MAHLEY, R. W. et al. Canine hyperlipoproteinemia and atherosclerosis. Accumulation of lipid by aortic medial cells in vivo and in vitro. American Journal of Pathology, v. 87, n. 1, p. 205–225, 1977.
NRC. Nutrient Requirements of Dogs and Cats. 1. ed. Washington, D.C.: National Academy Press, 2006.
ORESIC, Matej et al. Dysregulation of lipid and amino acid metabolism precedes islet autoimmunity in children who later progress to type 1 diabetes. The Journal of experimental medicine, v. 205, n. 13, p. 2975-2984, 2008.
RUCINSKY, R. et al. AAHA diabetes management guidelines. Journal of the American Animal Hospital Association, v. 46, n. 3, p. 215–24, 2010
SOTTIAUX, J. Atherosclerosis in a dog with diabetes mellitus. Journal of Small Animal Practice, v. 40, n. 12, p. 581–584, 1999.
TEIXEIRA, Fábio Alves. Respostas metabólicas de cães diabéticos alimentados com dietas contendo diferentes concentrações de ômega-3. 2020. Tese de Doutorado. Universidade de São Paulo.
VENDRAMINI, Thiago HA et al. Serum metabolomics analysis reveals that weight loss in obese dogs results in a similar metabolic profile to dogs in ideal body condition. Metabolomics, v. 17, p. 1-13, 2021.
 br
br
 es
es
 en
en



