

Orientador(a): Márcio Antonio Brunetto
Instituição: FMVZ USP
Trabalho classificado na 9ª Edição (2023) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
Os beta-glucanos obtidos da parede celular de Saccharomyces cerevisiae (BG) podem modular o sistema imunológico e o microbioma intestinal de cães, no entanto, o teor ideal de inclusão em alimentos secos extrusados permanece desconhecido. Portanto, este estudo avaliou os efeitos da inclusão de níveis crescentes de BG (0,0%; 0,07%; 0,14%; 0,28%) em alimento extrusado seco sobre variáveis digestivas, imunológicas e microbiota fecal de cães adultos saudáveis. Quatro cães border collie e quatro cocker spaniel inglês machos e fêmeas, com idade de 3,5±0,5 anos e escore de condição corporal ideal foram distribuídos em dois quadrados latinos 4×4 balanceados. Em cada período, 28 dias foram destinados à adaptação às dietas e sete para coletas amostrais. Foram determinados os coeficientes de digestibilidade aparente (CDA) dos nutrientes, concentrações de ácidos graxos de cadeia curta e ramificada, nitrogênio amoniacal, ácido lático, IgA e pH fecais; imunofenotipagem de linfócitos, intensidade e porcentagem de fagocitose, burst oxidativo e microbiota fecal (Illumina® Sequencing). Os dados foram analisados por meio dos procedimentos PROC MIXED, PROC GLIMMIX e Tukey-Kramer (SAS, versão 9.4). Valores de p<0,05 foram considerados significativos. Não foram observadas diferenças entre as médias dos CDAs dos nutrientes avaliados. As concentrações dos produtos fermentativos avaliados e o pH fecais não diferiram após o consumo das dietas. Ademais, as variáveis imunológicas de intensidade e porcentagem de fagocitose, burst oxidativo, populações linfocitárias e IgA fecal não foram moduladas por nenhum dos tratamentos. Contudo, a inclusão de 0,14% de BG resultou em maior relação entre linfócitos T CD4+:CD8+ (p=0,0368). O índice de diversidade beta microbiana diferiu entre os tratamentos 0,0 e 0,14% de BG (p=0,047). Outrossim, foram observadas modulações positivas e negativas em cinco filos, 15 famílias e 25 gêneros após a ingestão das dietas com inclusão de BG. Os principais microrganismos presentes na microbiota canina, descritos na literatura, foram modulados após o consumo de 0,14% de BG. Diante do exposto, conclui-se que a inclusão de 0,14% de BG resultou nas melhores respostas e pode ser considerado o teor de inclusão ideal.
Introdução
Os beta-glucanos obtidos da parede celular de Saccharomyces cerevisiae (BG) são prebióticos amplamente utilizados na medicina humana (MURPHY; DAVIS; CARMICHAEL, 2010) e seus benefícios estendem-se a diversas espécies animais (DE OLIVEIRA; VETVICKA; ZANUZZO, 2019). Intrínsecos ao seu potencial de modulação microbiana, os BG demonstraram apresentar mecanismos de ação imunomoduladores, antioxidantes, antitumorais, hipoglicemiantes e hipocolesterolêmicos (LAZARIDOU; BILIADERIS, 2007).
Em cães, estudos que avaliaram os benefícios da suplementação de BG demonstraram efeitos benéficos no metabolismo da glicose (VETVICKA; DE OLIVEIRA, 2014; FERREIRA et al., 2022) e lipídios (FERREIRA et al., 2022; OLIVINDO et al., 2022), no estado imunológico (STUYVEN et al., 2010; RYCHLIK et al., 2013; DE OLVEIRA; ZANUZZO, 2019), em produtos do metabolismo fermentativo (THEODORO et al., 2019) e na modulação de importantes bactérias do microbioma intestinal (RENTAS et al., 2020; SANTOS et al., 2022).
Estas descobertas são reflexo do estudo de fibras prebióticas como promotoras de saúde em cães (JUGAN et al., 2017). Em revisão sistemática realizada para embasamento técnico, foram selecionados 38 experimentos que analisaram a suplementação de prebióticos na alimentação de cães. Destes, apenas seis buscaram avaliar efeitos dose-resposta e determinar a melhor dose de inclusão do prebiótico avaliado. Caracteriza-se, portanto, uma tendência em descobrir novas fontes e blends prebióticos ou mesmo elucidar mecanismos inéditos de prebióticos com benefícios já unânimes. Desta forma, os resultados obtidos variam em fonte e concentração, o que impossibilita concluir qual inclusão do prebiótico resulta em sua melhor eficiência biológica e financeira.
Apesar dos inúmeros benefícios relatados, nenhum estudo avaliou efeitos dose-resposta de BG na dieta de cães saudáveis. Diante do exposto, o presente estudo teve como objetivo avaliar os efeitos da inclusão de 0,0; 0,07; 0,14 e 0,28% de BG em dieta extrusada seca em variáveis digestivas, imunológicas e da microbiota fecal de cães adultos saudáveis.
Material e métodos
O estudo foi conduzido de acordo com as normas da Comissão de Ética no Uso de Animais, sob número de protocolo 2866090223. Quatro cães border collie e quatro cocker spaniel inglês machos e fêmeas, com idade de 3,5±0,5 anos e escore de condição corporal ideal (LAFLAMME, 1997) foram distribuídos aleatoriamente em dois quadrados latinos 4×4 balanceados. Foram formulados e extrusados quatro alimentos experimentais isonutritivos, com inclusão de BG em teores crescentes (0,0%; 0,07%; 0,14%; 0,28%). A necessidade energética de manutenção dos cães foi determinada por meio da equação 95kcal/peso corporal0,75 (FEDIAF, 2021). Cada período apresentou duração total de 35 dias, os quais foram divididos em 28 dias para adaptação às dietas e sete dias para a coleta de amostras fecais e sanguíneas. Foram determinados os coeficientes de digestibilidade aparente (CDA) dos nutrientes (AAFCO, 2019), concentrações fecais de ácidos graxos de cadeia curta (AGCC), ácidos graxos de cadeia ramificada (AGCR), nitrogênio amoniacal, ácido lático, IgA e pH (FERREIRA et al., 2016). Nas amostras de sangue total foram determinadas a imunofenotipagem de linfócitos, intensidade e porcentagem de fagocitose, burst oxidativo por meio da leitura em citometria de fluxo e, também nas fezes, caracterização da microbiota fecal por Illumina® Sequencing. Nas análises com efeito significativo de variância, utilizou-se o teste de médias Tukey-Kramer. Todas as avaliações estatísticas foram realizadas com auxílio dos procedimentos PROC MIXED e PROC GLIMMIX, do programa SAS, versão 9.4. Valores de p<0,05 foram considerados significativos.
Resultados
Durante todo o protocolo experimental, os cães permaneceram hígidos e não foram relatados episódios de diarreia ou êmese. O acompanhamento da ingestão alimentar diário confirmou a ingestão completa das refeições e a manutenção do peso e escore de condição corporal dos animais. Portanto, não houve necessidade em realizar ajustes dietéticos ou retirar qualquer animal deste estudo.
O peso corporal médio dos animais foi 17,55 ± 5,47kg e o consumo alimentar diário médio foi de 221,38 ± 53,88g. O produto comercial utilizado como fonte de BG detém 60% de pureza. Portanto, a ingestão deste prebiótico em cada dieta, em mg/kg, foi: 0mg após consumo de 0,0% de BG; 5,30mg após consumo de 0,07% de BG; 10,60mg após consumo de 0,14% de BG e; 21,20mg após consumo de 0,28% de BG. Em relação às determinações dos coeficientes de digestibilidade aparente dos nutrientes, as análises bromatológicas dos quatro alimentos experimentais apontaram valores de composição química similares entre si.
Ademais, não foram observadas diferenças entre as médias dos CDAs de matéria seca, matéria orgânica, proteína bruta, extrato etéreo, matéria mineral, fibra bruta e extrativos não-nitrogenados.
Diante das avaliações de produtos fermentativos e pH nas amostras de fezes dos cães, não foi possível verificar diferenças entre as médias de concentração obtidas nos quatro tratamentos para as variáveis de nitrogênio amoniacal, ácido lático, ácidos graxos e pH (Tabela 1).
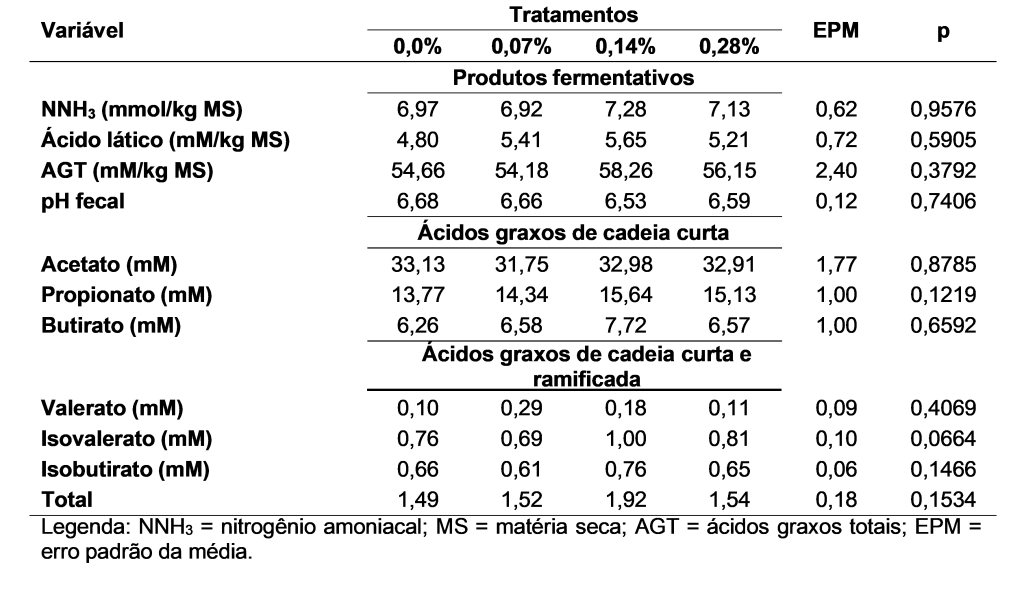
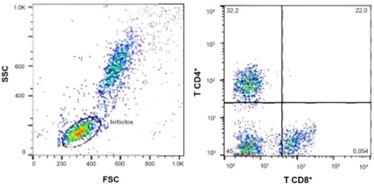
Ademais, foi observada modulação na imunidade adaptativa dos animais, caracterizada por diferença entre a média da variável índice T CD4+:CD8+ dos cães que consumiram 0,14% de BG, comparada com os cães que consumiram 0,0% de BG (Tabela 2; Figura 1). Acerca da porcentagem de fagocitose, intensidade de fagocitose, burst oxidativo, porcentagens de população de linfócitos T CD4+ e T CD8+ e concentração de IgA fecal, não foram observadas diferenças.
Por meio da análise metagenômica da microbiota fecal dos animais, não foram encontradas diferenças nas métricas de diversidade alfa, determinadas pelos índices de diversidade filogenética de Faith (p=0,1414) e uniformidade de Pielou (p=0,1151). A determinação do índice de diversidade beta, avaliada por meio de análise de coordenadas principais 3D, apontou agrupamento dos tratamentos experimentais entre os eixos, o que indica pouca variação entre os animais. No entanto, houve diferença entre a microbiota dos cães que consumiram o tratamento 0,0% de BG quando comparado aos que ingeriram 0,14% de BG (p=0,047).
Por meio do sequenciamento das amostras dos quatro grupos experimentais, foram identificadas diferenças entre as médias de abundância relativa para cinco filos, 15 famílias e 25 gêneros distintos. As modulações observadas nos principais grupos taxonômicos estão apresentadas na Tabela 3. De forma geral, o filo Firmicutes foi o mais abundante em todos os tratamentos, seguido de Fusobacteria nos tratamentos 0,0%; 0,07% e 0,28% de BG e Bacteroidetes no tratamento 0,14%. Os filos menos representativos foram Proteobacteria e Actinobacteria, respectivamente.
O filo Firmicutes, as famílias Erysipelotrichaceae e Ruminococcaceae e o gênero Faecalibacterium apresentaram maior abundância relativa após consumo de 0,14% de BG e; os filos Fusobacteria e Proteobacteria, as menores abundâncias relativas após consumo deste mesmo tratamento. O filo Bacteroidetes apresentou redução em sua abundância relativa após o consumo das dietas com inclusão de BG. Apesar disso, o gênero Prevotella apresentou aumento em sua abundância relativa após o consumo de 0,14 e 0,28% de BG. Ademais, a família Lachnospiraceae e o gênero Turicibacter apresentaram maior modulação após consumo de 0,28% de BG. Por fim, o gênero Blautia apresentou maior média após consumo de 0,07 e 0,28% de BG.

Discussão
Estão presentes na literatura, evidências científicas que corroboram os benefícios da suplementação de BG em cães. Todavia, este estudo foi pioneiro na avaliação dose-resposta da inclusão deste prebiótico em alimento extrusado seco. Estudos pregressos relataram que a ingestão de BG em cães pode levar a perdas na digestibilidade de determinados nutrientes (FERREIRA et al., 2018; THEODORO et al., 2019; SANTOS et al., 2022). Neste caso, a fonte e os teores de inclusão de BG não causaram redução da digestibilidade dos nutrientes avaliados, o que garante ideal aproveitamento da dieta (LIN et al., 2019).
A avaliação dos produtos do metabolismo fermentativo e pH fecais objetiva qualificar o estado de saúde intestinal dos animais. Os AGCR e a amônia são indesejáveis, uma vez que são compostos putrefativos e podem causar prejuízos ao intestino (NERY et al., 2012). Por outro lado, os AGCC e o ácido lático são compostos benéficos, pois promovem um ambiente mais favorável à proliferação de bactérias desejáveis (KAMADA et al., 2013). Apesar de esperadas modulações nas concentrações, a ausência de diferença nestas variáveis fecais é um achado bastante comum, relacionado com a possível degradação dos compostos ao longo do intestino até a excreção (SWANSON et al., 2002; RENTAS et al., 2020).
Foram mensuradas variáveis que refletem a condição da imunidade inata, adaptativa e intestinal (SWANSON et al., 2002). No entanto, a condição de higidez e ausência de desafios imunológicos ao longo da execução do estudo pode ter influenciado a ausência de melhorias no estado imune (WILSON et al., 2023). Por outro lado, a diferença encontrada na relação entre os linfócitos T CD4+ e T CD8+ sugere incremento da resposta adaptativa de cães adultos saudáveis. Este índice é um importante marcador do sistema imunológico e reduções nessa variável já foram documentadas em cães idosos e cães com demodicoses generalizadas (BLOUNT; PRITCHARD; HEATON, 2005; SINGH et al., 2010).
A avaliação filogenética de diversidade beta determina quão dissimilares são as microbiotas caracterizadas, ao compará-las entre si (KERS; SACCENTI, 2022). Portanto, a variabilidade taxonômica observada sugere que o consumo de 0,14% de BG é capaz de alterar a microbiota de cães adultos saudáveis. Apesar de ser muito heterogêneo e compreender diversos grupos filogenéticos, o filo Firmicutes é considerado desejável para o microbioma intestinal canino (SUCHODOLSKI, 2011). Tal como as famílias Erysipelotrichaceae e Ruminococcaceae e os gêneros Faecalibacterium e Prevotella, considerados benéficos por envolvimento na produção de ácidos graxos de cadeia curta e outros metabólitos (HANDL et al., 2011; BERMINGHAM et al., 2017). Todos estes grupos de bactérias citados acima apresentaram-se em maior abundância após o consumo de 0,14% de BG. Por outro lado, o tratamento 0,14% de BG apresentou as menores populações de Proteobacteria, considerado potencialmente patogênico (MUKHOPHADYA et al., 2012), e Fusobacterium, gênero bacteriano que apresenta evidências contraditórias até o momento (VAZQUEZ-BAEZA et al., 2016; MACEDO et al., 2022).
Conclusão
Conclui-se que a inclusão dos teores testados não altera a digestibilidade dos nutrientes da dieta. Ademais, as modulações observadas sobre a imunidade adaptativa, índice de diversidade beta microbiana, filos, famílias e gêneros bacterianos benéficos permitem afirmar que o tratamento com inclusão de 0,14% de BG resultou na melhor resposta pelos cães e pode ser considerado o teor de inclusão ideal.
Referências bibliográficas
AAFCO. Association of American Feed Control Officials. Washington, DC: Official Publication, 2019.
BERMINGHAM, E. N. et al. Key bacterial families (Clostridiaceae, Erysipelotrichaceae and Bacteroidaceae) are related to the digestion of protein and energy in dogs. PeerJ, v. 5, p. e3019, 2017.
BLOUNT, D. G. et al. Age-related alterations to immune parameters in Labrador retriever dogs. Veterinary Immunology and Immunopathology, v. 108, p. 399- 407, 2005.
DE OLIVEIRA, C. A. F.; VETVICKA, V.; ZANUZZO, F. S. β-Glucan successfully
stimulated the immune system in different jawed vertebrate species. Comparative Immunology, Microbiology and Infectious Diseases, v. 62, p. 1–6, 2019.
DI CERBO, A. et al. Functional foods in pet nutrition: Focus on dogs and cats.
Research in Veterinary Science, v. 112, p. 161–166, 2017.
FEDIAF. The European Pet Food Industry Federation. Nutritional guidelines for complete and complementary pet food for cats and dogs. Bruxelas, BE: The European Pet Food Industry Federation, 2021.
FERREIRA, C. S. et al. Metabolic variables of obese dogs with insulin resistance supplemented with yeast beta-glucan. BMC Veterinary Research, v. 18, p. 14, 2022.
FERREIRA, E. M. et al. Nutrient digestibility and ruminal fatty acid metabolism in lambs supplemented with soybean oil partially replaced by fish oil blend. Animal Feed Science and Technology, v. 216, p. 30–39, 2016.
FERREIRA, L. G. et al. Oat beta-glucan as a dietary supplement for dogs. PLoS ONE, v. 13, p. e0201133, 2018.
HANDL, S. et al. Faecal microbiota in lean and obese dogs. Federation of European Microbiological Societies Microbiology Ecology, v. 84, p. 332–343, 2013.
JUGAN, M. C. et al. Use of probiotics in small animal veterinary medicine. Journal of the American Veterinary Medical Association, v. 250, p. 519–528, 2017.
KAMADA, N. et al. Control of pathogens and pathobionts by the gut microbiota.
Nature Immunology, v. 14, p. 685–690, 2013.
KANAKUPT, K. et al. Effects of short-chain fructooligosaccharides and galactooligosaccharides, individually and in combination, on nutrient digestibility, fecal fermentative metabolite concentrations, and large bowel microbial ecology of healthy adult cats. Journal of Animal Science, v. 89, p. 1376–1384, 2011.
KERS, J. G.; SACCENTI, E. The Power of Microbiome Studies: Some Considerations on Which Alpha and Beta Metrics to Use and How to Report Results. Frontiers in Microbiology, v. 12, p. 796025, 2022.
LAFLAMME, D. Development and Validation of a Body Condition Score System for Dogs. Canine Practice, v. 22, p. 10–15, 1997.
LAZARIDOU, A.; BILIADERIS, C. G. Molecular aspects of cereal β-glucan functionality: Physical properties, technological applications and physiological effects. Journal of Cereal Science, v. 46, p. 101–118, 2007.
LIN, C.-Y. et al. Effects of a Saccharomyces cerevisiae fermentation product on fecal characteristics, nutrient digestibility, fecal fermentative end-products, fecal microbial populations, immune function, and diet palatability in adult dogs. Journal of Animal Science, v. 97, p. 1586–1599, 2019.
MACEDO, H. T. et al. Weight-loss in obese dogs promotes important shifts in fecal microbiota profile to the extent of resembling microbiota of lean dogs. Animal Microbiome, v. 4, p. 6, 2022.
MUKHOPADHYA, I. et al. IBD-what role do Proteobacteria play? Nature Reviews Gastroenterology & Hepatology, v. 9, p. 219–230, 2012.
MURPHY E. A.; DAVIS, J. M.; CARMICHAEL, M. D. Immune modulating effects of betaglucan, Current Opinion in Clinical Nutrition & Metabolic Care, v. 13, p. 656–661, 2010.
NERY, J. et al. Influence of dietary protein content and source on colonic fermentative activity in dogs differing in body size and digestive tolerance. Journal of Animal Science, v. 90, p. 2570–2580, 2012.
OLIVINDO, R. F. G. et al. Lipid and glycemic response of diabetic dogs supplemented with beta-glucan. In: CONGRESS OF THE EUROPEAN SOCIETY OF VETERINARY AND COMPARATIVE NUTRITION, 26th, 2022, Basileia.
Congress Proceedings, Áustria: European Society of Veterinary & Comparative Nutrition, 2022, p. 73.
RENTAS, M. F. et al. Galactoligosaccharide and a prebiotic blend improve colonic health and immunity of adult dogs. PLoS ONE, v. 15, p. 1–13, 2020.
RYCHLIK, A. et al. The effectiveness of natural and synthetic immunomodulators in the treatment of inflammatory bowel disease in dogs. Acta Veterinaria Hungarica, v. 61, p. 297–308, 2013.
SANTOS, K. M. et al. Saccharomyces cerevisiae dehydrated culture modulates fecal microbiota and improves innate immunity of adult dogs. Fermentation, v. 8, p. 2, 2022.
SINGH, S. K. et al. Determination of CD4+ and CD8+ T cells in the peripheral blood of dogs with demodicosis. Parasitology, v. 137, p. 1921–1924, 2010.
STUYVEN, E. et al. Oral administration of beta-1,3/1,6-glucan to dogs temporally changes total and antigen-specific IgA and IgM. Clinical and Vaccine Immunology, v. 17 p. 281–285, 2010.
SUCHODOLSKI, J. S. Microbes and gastrointestinal health of dogs and cats.
Journal of Animal Science, v. 89, p. 1520–1530, 2011.
SWANSON, K. S. et al. Supplemental fructooligosaccharides and mannanoligosaccharides influence immune function, ileal and total tract nutrient digestibilities, microbial populations and concentrations of protein catabolites in the large bowel of dogs. Journal of Nutrition, v. 132, p. 980–989. 2002.
THEODORO, S. S. et al. Effects of the solubility of yeast cell wall preparations on their potential prebiotic properties in dogs. PLoS ONE, v. 14, p. e0225659, 2019.
TIZARD, I. R.; JONES, S. W. The Microbiota Regulates Immunity and Immunologic Diseases in Dogs and Cats. The Veterinary clinics of North America – Small Animal Practice, v. 48, p. 307-322, 2018.
TURNBAUGH, P. J. et al. The human microbiome project. Nature, v. 449, p. 804– 810, 2007.
VAZQUEZ-BAEZA, Y. et al. Dog and human inflammatory bowel disease rely on overlapping yet distinct dysbiosis networks. Nature Microbiology, v. 1, p. 16177, 2016.
VETVICKA, V.; OLIVEIRA, C. β(1-3)(1-6)-D-glucans Modulate Immune Status and Blood Glucose Levels in Dogs. British Journal of Pharmaceutical and Medical Research, v. 4, p. 981–991, 2014.
WILSON, S. M. et al. Effects of a Saccharomyces cerevisiae fermentation product- supplemented diet on fecal characteristics, oxidative stress, and blood gene expression of adult dogs undergoing transport stress. Journal of Animal Science, v. 101, p. skac378, 2023.
 br
br
 es
es
 en
en



