

Orientador(a): Ananda Portella Félix
Instituição: UFRP
Trabalho Aprovado na 7ª Edição (2021) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
Os alimentos completos comerciais para cães adultos apresentam grande variação nos níveis de proteína bruta (PB). E embora os aminoácidos das proteínas sejam essenciais aos cães, o excesso do consumo desses nutrientes pode alterar a produção de metabólitos pela microbiota intestinal, os quais incluem: amônia, aminas biogênicas, ácidos graxos de cadeia ramificada (AGCR), fenóis e indol. Esses compostos putrefativos são os principais responsáveis pelo odor das fezes e em excesso podem ser tóxicos à mucosa intestinal, podendo inclusive aumentar o risco de distúrbios gastrointestinais. Nesse contexto, o objetivo desta revisão sistemática e meta-análise é avaliar o impacto da concentração de proteína dietética na produção de metabólitos de fermentação intestinal de cães. Foram selecionados nove artigos científicos publicados de 2012 a 2020 para a meta- análise. Todos os artigos selecionados avaliaram os efeitos de níveis dietéticos moderado e alto de proteína sobre pelo menos um dos produtos de fermentação intestinal e/ou pH fecal de cães. A meta-análise foi conduzida utilizando o modelo de efeitos aleatórios com variância inversa, gerando uma estimativa combinada da diferença média padronizada entre os grupos moderada (PB = 17,8 a 26%) e alta proteína (PB = 30,4 a 76,3%). A heterogeneidade entre os estudos foi avaliada pelo teste Qui-quadrado e estatística I2. Foi observada maior concentração de amônia, AGCR totais e indol e maior pH nas fezes dos cães que consumiram dietas com alta proteína, em comparação aos alimentados com nível moderado (P<0,05). Desse modo, conclui-se que altos níveis dietéticos de proteínas (acima de 30,4%) resultam em aumento na produção de metabólitos de fermentação nitrogenada intestinal em cães.
PALAVRAS-CHAVE: canino, microbiota, modulação intestinal, níveis proteicos.
Introdução
A recomendação mínima de proteína bruta (PB) para a manutenção de cães adultos é de 52,1 g/1000 kcal de dieta ou 18% (dieta com 4,0 kcal/g), considerando necessidade energética de 95 kcal/kg de peso corporal0,75 (FEDIAF, 2020). No entanto, no mercado são encontrados alimentos comerciais para cães contendo grande variação na concentração de PB, variando de 18% a mais de 60%. Essa variação nem sempre tem justificativa técnica, sendo muitas vezes influenciada por questões mercadológicas, como segmento de mercado e preferência dos tutores.
Grande parte da proteína dietética é digerida no trato gastrointestinal (TGI) superior. Entretanto, a ingestão excessiva de proteínas, mesmo quando proveniente de fontes de alta digestibilidade, pode exceder a capacidade digestiva e absortiva do TGI, levando à maior concentração de compostos nitrogenados no colón (BERMINGHAM et al., 2017; NERY et al., 2012). Como o cólon é um segmento intestinal com intensa atividade microbiana, os compostos nitrogenados não absorvidos no intestino delgado se tornam substrato para fermentação pela microbiota. Consequentemente, ocorre a síntese de catabólitos como: amônia, aminas biogênicas, ácidos graxos de cadeia ramificada (AGCR), fenóis e indol (BASTOS et al., 2020; EPHRAIM; COCHRANE; JEWELL, 2020). Esses compostos são os principais responsáveis pelo odor das fezes e podem ter influência negativa à funcionalidade intestinal, devido ao seu potencial tóxico à mucosa. Ainda, por aumentarem o pH intestinal, podem favorecer o desenvolvimento de bactérias com potencial patogênico, como algumas espécies de Clostridium, Streptococcus e E. coli, as quais estão associadas a doenças inflamatórias intestinais (CELI et al., 2017; BASTOS et al., 2020; PILLA; SUCHODOLSKI et al., 2020; WERNIMONT et al., 2020).
Embora seja esperado que o maior consumo de proteína resulte no aumento da formação desses catabólitos no intestino, ainda não há consenso se isso também ocorre em cães, considerando que devido à sua filogenia, apresentam TGI adaptado à digestão e absorção de aminoácidos (DEPAUW et al., 2013; VERBRUGGHE et al., 2010). Diante do exposto, essa revisão sistemática e meta- análise objetivou analisar as evidências disponíveis sobre a contribuição dos níveis de proteína dietética para cães na produção de metabólitos de fermentação intestinal. Compreender as interações subjacentes entre componentes da dieta e microbiota intestinal nos permite aprimorar o desenvolvimento de estratégias nutricionais com seleção criteriosa dos níveis dietéticos de proteína para a saúde intestinal e geral dos cães. Ainda, é importante salientar que a proteína é um macronutriente de custo elevado, tanto do ponto de vista econômico quanto ecológico. Portanto, novas perspectivas sobre o uso de proteína dietética podem gerar alternativas para a indústria na redução do desperdício e, consequentemente, do impacto ambiental.
Material e Métodos
A pesquisa de literatura foi realizada de acordo com as diretrizes do Preferred Reporting Items for Systematic Review and Meta-Analysis Protocols – PRISMA-P (MOHER et al., 2015). Os termos foram pesquisados na língua Inglesa, os quais incluíram: (dog* OR canine*) AND (“protein level*” OR “protein concentration*” OR “high protein”) AND (feces OR faeces OR fecal OR faecal) AND (ammonia OR amines OR “short-chain fatty acids” OR “branched-chain fatty acids” OR phenol* OR indol* OR pH). Foram considerados apenas artigos científicos publicados após revisão por pares na Web of Science e Pubmed até 20 de janeiro de 2021.
Todos os estudos foram revisados de forma independente por dois pesquisadores. Os estudos relevantes foram, então, selecionados para leitura detalhada do texto completo para identificar as publicações elegíveis. Quatro critérios de inclusão de estudos foram considerados: 1) Ensaios randomizados controlados com avaliação de metabólitos de fermentação intestinal nas fezes de cães; 2) Estudos que compararam fezes de cães alimentados com níveis dietéticos de proteína moderado e alto; 3) Estudos em que as características nutricionais da dieta, condições experimentais e de saúde dos animais foram bem descritos e forneceram dados suficientes para calcular a diferença média (DM) e intervalo de confiança (IC), 95%. 4) Estudos que incluíram pelo menos uma das variáveis de interesse com resultados quantitativos.
Dois pesquisadores extraíram independentemente os dados dos estudos elegíveis. Os dados extraídos incluíram: sobrenome do primeiro autor, ano do estudo, delineamento, número e características dos animais, duração, descrição dos tratamentos, variáveis avaliadas e unidade de cada variável. Quando dois ou mais tratamentos similares foram avaliados em um estudo, os dados foram combinados como um grupo para análise. Os dados relatados como medianas e valores mínimos e máximos ou interquartis foram transformados em média e desvio padrão de acordo com Mcgrath et al. (2020). Um modelo de efeitos aleatórios com variância inversa foi usado para produzir uma estimativa combinada da diferença média padronizada (DMP) entre os grupos de cães alimentados com moderada (PB = 17,8 a 26%) e alta proteína (PB = 30,4 a 76,3%).
Inconsistências entre os estudos foram avaliadas pelo teste Qui-quadrado (P<0,05) e estatística I2, na qual foi definida heterogeneidade significativa como I2 ≥ 50%. O risco de viés das publicações foi avaliado pela contribuição de cada estudo na heterogeneidade dos dados. Desse modo, se um estudo contribuiu com mais de 20% da heterogeneidade total pelo I2, o mesmo foi removido da análise. Todos os cálculos foram feitos no software Review Manager – RevMan (versão 5.4.1; Colaboração Cochrane), o qual também gerou os gráficos Forest plot.
Resultados
Na busca inicial do banco de dados um total de 746 registros foram identificados. Depois de remover duplicatas e excluir estudos inelegíveis, nove publicações entre os anos de 2012 a 2020 (APPER et al., 2020; BERMINGHAM et al., 2017; DOS REIS et al., 2016; EISENHAUER et al., 2019; EPHRAIM; COCHNOSSRANE; JEWELL, 2020; HANG et al., 2013; NERY et al., 2012; PINNA et al., 2018; XU et al., 2017) foram elegíveis para serem incluídos nesta revisão sistemática e meta-análise. Não foram encontrados estudos suficientes com dados sobre aminas biogênicas e fenóis. Os nove estudos primários analisaram ao todo 821 cães. Todos os estudos avaliaram dietas secas extrusadas, com exceção de um, que também avaliou dieta crua composta por carne fresca. As principais fontes proteicas utilizadas nas dietas dos estudos foram: proteína isolada de suíno, farinha de vísceras de aves, ovo em pó, farelo de glúten de milho 60, glúten de trigo e farelo de soja. A digestibilidade da PB das dietas variou entre 83% a 98%.
Foi observada maior concentração de amônia, AGCR totais, isobutirato e indol e maior pH nas fezes dos cães que consumiram dietas com alta proteína, em comparação aos alimentados com nível moderado (P<0,05, Tabela 1 e Figura 1). Não foi encontrado efeito dos níveis proteicos da dieta sobre a concentração fecal de isovalerato dos cães (P>0,05). Houve heterogeneidade entre os estudos (I2 = 64 a 83%, P<0,05), com exceção dos dados de AGCR totais, os quais não se mostraram heterogêneos (I2= 34%, P>0,05, Tabela 1). Como o número de estudos encontrados foi relativamente pequeno, não foi possível dividir os trabalhos em subgrupos (ex.: por fontes proteicas ou digestibilidade), para tentar reduzir a heterogeneidade.
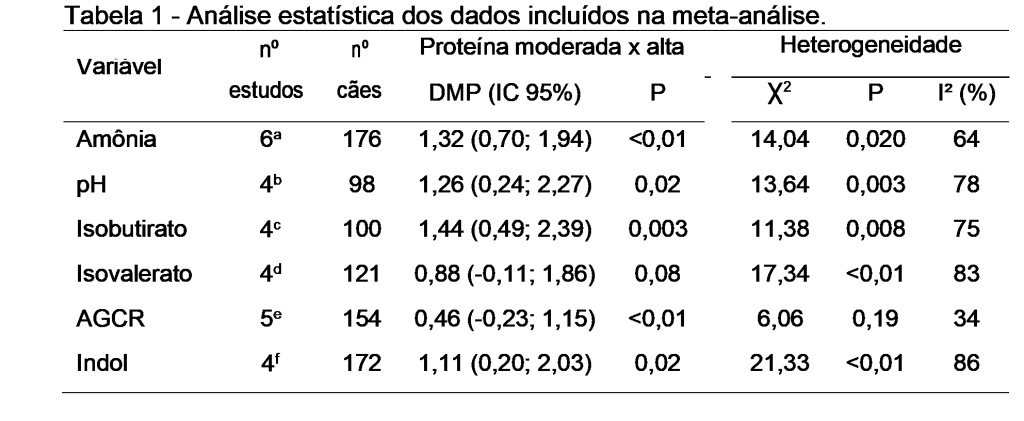
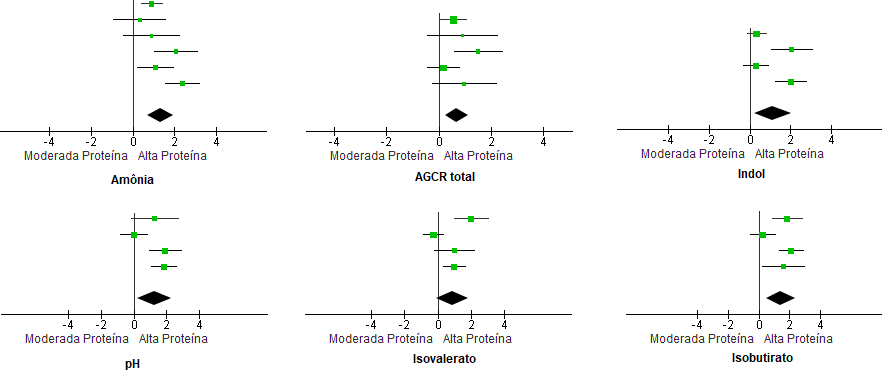
Discussão
Com base na meta-análise dos dados da literatura, foi encontrado que a concentração de catabólitos de fermentação nitrogenada nas fezes é maior em cães alimentados com dietas contendo alta concentração de PB. Esses resultados foram independentes das fontes proteicas avaliadas nos estudos. Ou seja, mesmo com o consumo de fontes proteicas de alta digestibilidade, houve maior produção desses catabólitos, quando comparado com o menor consumo de PB.
A degradação de proteínas no cólon começa pela hidrólise por proteases e peptidases bacterianas, liberando peptídeos menores e aminoácidos. Após, os aminoácidos que não foram incorporados à célula bacteriana são desaminados ou descarboxilados, gerando diferentes catabólitos (BOUDRY; HUËROU-LURON; MICHEL, 2016).
A produção de amônia é desencadeada principalmente pela desaminação de aminoácidos no cólon e em menor grau pela hidrólise da ureia, por meio da urease bacteriana (DAVILA et al., 2013), sendo um dos catabólitos mais tóxicos à mucosa intestinal. Estudos em ratos alimentados com dietas com alta proteína relataram influência da amônia intestinal no metabolismo oxidativo dos colonócitos. Maiores concentrações de amônia no intestino inibiram o consumo de oxigênio pela mitocôndria e reduziram o metabolismo do acetato e butirato. Ainda, houve redução na taxa de renovação dos colonócitos e aumento da permeabilidade intestinal, demonstrando importante efeito adverso sobre a integridade da mucosa (ANDRIAMIHAJA et al., 2010; BOUDRY; HUËROU-LURON; MICHEL, 2016).
A produção de AGCR é exclusiva da fermentação bacteriana de aminoácidos de cadeira ramificada, como valina (gera o isobutirato), leucina (gera o isovalerato) e isoleucina (gera o 2-metilbutirato). Do mesmo modo, o indol é oriundo da fermentação do triptofano (DIETHER; WILLING, 2019). Como o organismo não produz enzimas capazes de sintetizar os AGCR e o indol, a sua excreção nas fezes é considerada um marcador direto da taxa de fermentação proteica no cólon.
Os efeitos dos AGCR e indol no intestino ainda não são completamente compreendidos. Entretanto, estudos in vitro e em ratos relatam efeito citotóxico aos colonócitos e aumento da virulência de bactérias patogênicas pela maior concentração de indol (BOUDRY; HUËROU-LURON; MICHEL, 2016) e maior excreção de citocinas pró-inflamatórias pelo isovalerato (VAN NUENEN et al., 2005).
Além dos efeitos supracitados, os compostos de degradação nitrogenada contribuem com o aumento do pH no intestino, como foi encontrado pela meta- análise. O maior pH do conteúdo intestinal, associado à maior concentração de substrato nitrogenado, contribui com a modulação da microbiota, favorecendo o desenvolvimento de microrganismos com potencial patogênico (Escherichia coli, Clostridium sp., Streptococcus sp.) e, consequentemente, reduzindo os não- patogênicos sensíveis ao maior pH (Faecalibacterium e Bifidobacterium, por exemplo) (ALEXANDER et al., 2019; EPHRAIM; COCHRANE; JEWELL, 2020).
Estas mudanças na microbiota, juntamente com os mecanismos deletérios citados anteriormente, podem afetar negativamente a mucosa intestinal e a saúde geral dos animais (MA et al., 2017).
Outro possível efeito negativo do consumo de dietas contendo alta concentração de proteínas pelos cães seria o maior odor fecal. Os compostos de fermentação nitrogenada são os principais responsáveis pelo mau odor das fezes, sendo esta, uma característica relevante para os tutores (DETWEILER et al., 2019). Neste sentido, níveis moderados de proteínas de alta digestibilidade seriam recomendados para cães adultos saudáveis, principalmente com base nas evidências de que a ingestão excessiva de proteínas pode afetar a saúde intestinal. Apesar disso, cabe citar que há escassez de estudos avaliando os possíveis efeitos tóxicos dos catabólitos de fermentação nitrogenada especificamente na mucosa intestinal de cães. Apenas um estudo (HANG et al., 2013) foi encontrado, no qual os autores relacionaram o aumento na concentração de amônia e AGCR fecais, com a maior produção de calprotectina (marcador de inflamação intestinal) nos cães alimentados com uma dieta contendo alta proteína. Desse modo, ainda há a necessidade de maiores estudos. Principalmente considerando que por terem evoluído a partir de canídeos carnívoros, como o lobo cinzento, os cães podem ter mecanismos compensatórios para mitigar os efeitos deletérios dos compostos de fermentação nitrogenada sobre a saúde intestinal.
Conclusão
A inclusão de alta proteína na dieta para cães aumenta a concentração de amônia, AGCR e indol e aumenta o pH fecal. Considerando que o aumento nesses catabólitos pode ser prejudicial à funcionalidade intestinal e saúde geral do organismo, é importante reavaliar os reais benefícios de dietas com altas concentrações proteicas para cães.
Referências bibliográficas
ALEXANDER, Celeste et al. Cholestyramine decreases apparent total tract macronutrient digestibility and alters fecal characteristics and metabolites of healthy adult dogs. Journal of Animal Science, v. 97, n. 3, p. 1020-1026, 2019.
ANDRIAMIHAJA, Mireille et al. Colon luminal content and epithelial cell morphology are markedly modified in rats fed with a high-protein diet. American Journal of Physiology-Gastrointestinal and Liver Physiology, v. 299, n. 5, p. G1030- G1037, 2010.
APPER, Emmanuelle et al. Relationships between gut microbiota, metabolome, body weight, and glucose homeostasis of obese dogs fed with diets differing in prebiotic and protein content. Microorganisms, v. 8, n. 4, p. 513, 2020.
BASTOS, Tais S. et al. Bacillus subtilis and Bacillus licheniformis reduce faecal protein catabolites concentration and odour in dogs. BMC Veterinary Research, v. 16, p. 1-8, 2020.
BERMINGHAM, Emma et al. Key bacterial families (Clostridiaceae, Erysipelotrichaceae and Bacteroidaceae) are related to the digestion of protein and energy in dogs. PeerJ, v. 5, p. e3019, 2017.
BOUDRY, Gaëlle; LE HUËROU-LURON, Isabelle; MICHEL, Catherine. Dietary Protein and Colonic Microbiota: Molecular Aspects. In: The Molecular Nutrition of Amino Acids and Proteins. Academic Press, 2016. p. 207-220.
CELI, Pietro et al. Gastrointestinal functionality in animal nutrition and health: new opportunities for sustainable animal production. Animal Feed Science and Technology, v. 234, p. 88-100, 2017.
DAVILA, Anne-Marie et al. Re-print of “Intestinal luminal nitrogen metabolism: Role of the gut microbiota and consequences for the host”. Pharmacological Research, v. 69, n. 1, p. 114-126, 2013.
DEPAUW, Sarah et al. Animal fibre: The forgotten nutrient in strict carnivores? First insights in the cheetah. Journal of Animal Physiology and Animal Nutrition, v. 97, n. 1, p. 146-154, 2013.
DETWEILER, Katelyn B. et al. Extruded feline diets formulated with high inclusion of soybean hulls: effects on apparent total tract macronutrient digestibility, and fecal quality and metabolites. Journal of Animal Science, v. 97, n. 3, p. 1042-1051, 2019.
DIETHER, Natalie; WILLING, Benjamin. Microbial fermentation of dietary protein: an important factor in the diet–microbe-host interaction. Microorganisms, v. 7, n. 1, p. 19, 2019.
DOS REIS, Jéssica et al. Inclusion of Yucca schidigera extract in diets with different protein levels for dogs. Animal Science Journal, v. 87, n. 8, p. 1019-1027, 2016.
EISENHAUER, Laura et al. Effects of Brewer’s spent grain and carrot pomace on digestibility, fecal microbiota, and fecal and urinary metabolites in dogs fed low-or high-protein diets. Journal of Animal Science, v. 97, n. 10, p. 4124-4133, 2019.
EPHRAIM, Eden; COCHRANE, Chun-Yen; JEWELL, Dennis. Varying Protein Levels Influence Metabolomics and the Gut Microbiome in Healthy Adult Dogs. Toxins, v. 12, n. 8, p. 517, 2020.
FEDIAF. European Pet Food Industry Federation. Nutritional Guidelines for Complete and Complementary Pet Food for Cats and Dogs. Bruxelles: FEDIAF, 2020.
HANG, Ingrid et al. Impact of diets with a high content of greaves-meal protein or carbohydrates on faecal characteristics, volatile fatty acids and faecal calprotectin concentrations in healthy dogs. BMC Veterinary Research, v. 9, n. 1, p. 201, 2013.
MA, Ning et al. Contributions of the interaction between dietary protein and gut microbiota to intestinal health. Current Protein and Peptide Science, v. 18, n. 8, p. 795-808, 2017.
MCGRATH, Sean et al. Estimating the sample mean and standard deviation from commonly reported quantiles in meta-analysis. Statistical Methods in Medical Research, v. 29, n. 9, p. 2520-2537, 2020.
MOHER, David et al. Preferred reporting items for systematic review and meta- analysis protocols (PRISMA-P) 2015 statement. Systematic Reviews, v. 4, n. 1, p. 1-9, 2015.
NERY, Joana et al. Influence of dietary protein content and source on colonic fermentative activity in dogs differing in body size and digestive tolerance. Journal of Animal Science, v. 90, n. 8, p. 2570-2580, 2012.
PILLA, Rachel; SUCHODOLSKI, Jan. The role of the canine gut microbiome and metabolome in health and gastrointestinal disease. Frontiers in Veterinary Science, v. 6, p. 498, 2020.
PINNA, Carlo et al. Influence of dietary protein and fructooligosaccharides on fecal fermentative end-products, fecal bacterial populations and apparent total tract digestibility in dogs. BMC Veterinary Research, v. 14, n. 1, p. 1-10, 2018.
VAN NUENEN, Marleen H. M. C. et al. The influence of microbial metabolites on human intestinal epithelial cells and macrophages in vitro. FEMS Immunology & Medical Microbiology, v. 45, n. 2, p. 183-189, 2005.
VERBRUGGHE, Adronie et al. Intestinal fermentation modulate postprandial acylcarnitine profile and nitrogen metabolism in a true carnivore: the domestic cat (Felis catus). British Journal of Nutrition, v. 104, n. 7, p. 972-979, 2010.
XU, Jia et al. The response of canine faecal microbiota to increased dietary protein is influenced by body condition. BMC Veterinary Research, v. 13, n. 1, p. 1-11, 2017.
WERNIMONT, Susan M. et al. The effects of nutrition on the gastrointestinal microbiome of cats and dogs: impact on health and disease. Frontiers in Microbiology, v. 11, 2020.
Referências conforme ABNT NBR 6023





