

Orientador(a): Thiago Henrique Annibale Vendramini
Instituição: FMVZ USP
Trabalho classificado na 7ª Edição (2021) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A obesidade é uma doença que se expande a níveis epidêmicos e que acomete humanos e animais. O seu caráter multifatorial permite abordagens terapêuticas múltiplas, o que inclui a possibilidade de utilização de fármacos inibidores de apetite, de caráter anorexígenos. Não existe consenso quanto a utilização de tais medicamentos na medicina humana, e na medicina veterinária, trata-se de um tópico pouco discutido e explorado. O presente trabalho busca realizar uma revisão sobre os principais fármacos inibidores de apetite empregados, evidenciando seus mecanismos de ação e possível uso na medicina veterinária.
Abstract
Obesity is a disease that expands to epidemic levels affecting humans and animals. Its multifactorial nature allows multiple therapies, which include the possibility of using appetite-inhibiting drugs, of an anorectic nature. There is no consensus on the use of such drugs in human medicine and in veterinary medicine it is a topic that is little discussed and explored. The present work seeks to carry out a review of the main appetite suppressant drugs used, emphasizing their mechanisms of action and possible use in veterinary medicine.
Introdução
A obesidade é uma das desordens nutricionais mais frequentes em cães e gatos e mais importantes do mundo desenvolvido. A doença é caracterizada como o acúmulo excessivo de tecido adiposo no organismo, de forma sistêmica, o que acarreta prejuízos secundários para a saúde do animal (GERMAN, 2006). Independente da etiologia principal, seja ela vulnerabilidade genética, presença de ambiente permissível, comportamento alimentar ou desempenho do sistema de apetite por toda a abordagem terapêutica é estabelecida sobre um balanço energético negativo, isto é, em um determinado período de tempo o gasto energético do animal deve ser superior a sua ingestão calórica (ZORAN, 2010; OSTO & LUTZ, 2015) .
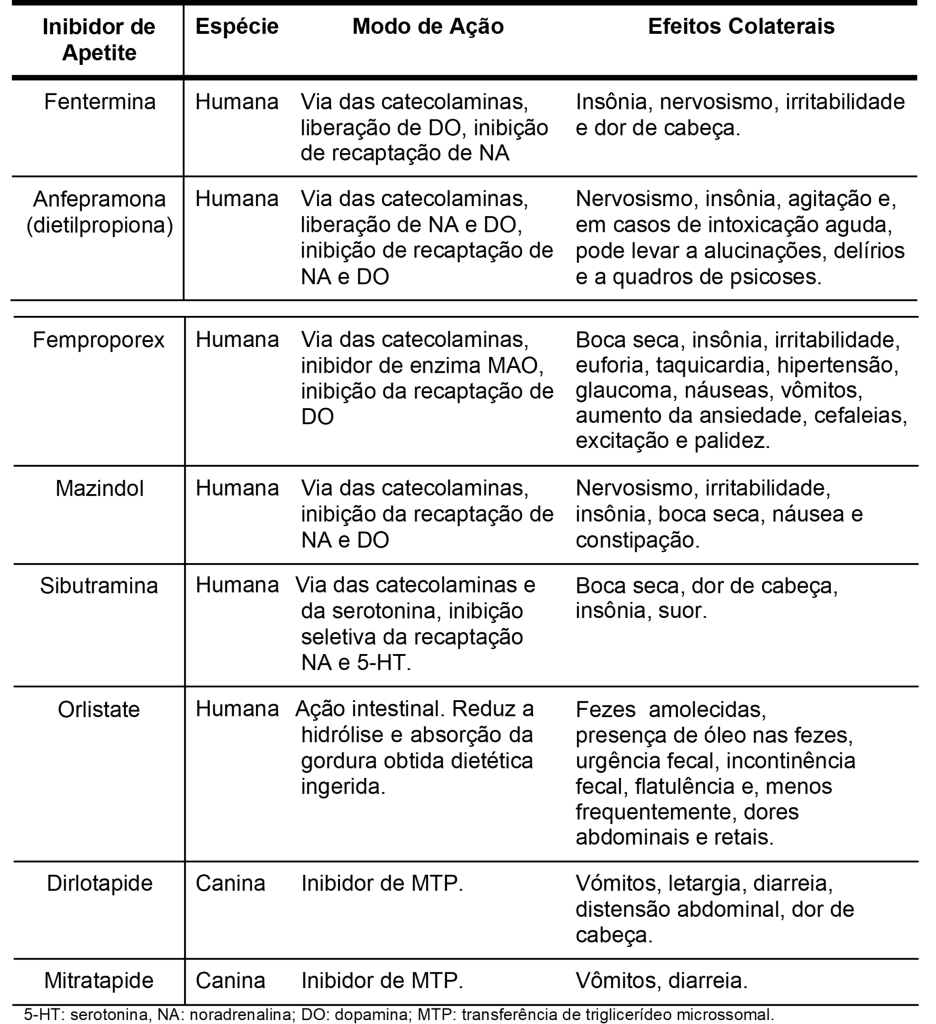
Nos humanos, como coadjuvante às estratégias de balanço energético negativo, encontra-se o emprego dos medicamentos inibidores de apetite. Estes são utilizados de forma complementar à dietas e atividades terapêuticas, visando a melhora na perda de peso (ABESO, 2010). Da mesma forma nas pessoas, o uso do tratamento farmacológico é indicado quando houver falha no tratamento não farmacológico de pacientes com sobrepeso ou obesidade, sendo que uma intervenção terapêutica é considerada eficaz quando há uma redução maior ou igual a 1% do peso corporal por mês (BRAY, 2010). Os inibidores de apetite propostos para este fim, devem seguir uma série de critérios, que consideram sua eficácia, efeitos colaterais e impactos positivos na vida do paciente. No caso da medicina humana no Brasil, existem 5 medicamentos registrados para colaborar com o tratamento da obesidade, cujos princípios ativos são: anfepramona (dietilpropiona), femproporex, mazindol, sibutramina e orlistate (BERLEZE, 2013) . Apesar de não ser um tipo de tratamento muito empregado em animais, existem fármacos anorexígenos veterinários aprovados nos Estados Unidos e na Europa, cujo composto ativo denominam-se, respectivamente, dirlotapide e mitratapide (GERMAN 2010).
Ainda sobre a obesidade, o processo de emagrecimento é capaz de reduzir a severidade das complicações associadas a ela, e até mesmo normalizar as alterações adquiridas pelo excesso de peso (BRUNETTO et al., 2011; PEREIRA-NETO et al., 2010; PEREIRA-NETO et al., 2018; VENDRAMINI, 2019).
Entretanto, a ausência ou diminuição da percepção de saciedade pelo animal e seu tutor é cada dia maior e um grande desafio durante um programa de perda de peso. Apesar da grande importância da saciedade neste processo, e vigente especulação do assunto pelos tutores, são escassos os estudos que avaliaram a utilização de inibidores do apetite durante os programas de perda peso, e a revisão prévia deste tema se faz necessária até para auxílio aos médicos veterinários que atuam neste segmento, objetivos do presente trabalho.
Desenvolvimento
O desenvolvimento da obesidade não é resumido simplesmente a um consumo energético excessivo. A questão envolve um consumo energético que constantemente supera o gasto de energia, resultando em um balanço positivo (MCCRORY et al., 2000; LUND et al., 2006; ZORAN, 2010; LAFLAMME, 2011; OSTO E LUTZ, 2015).
A regulação da ingestão de alimento (expressão do apetite) se dá através de dois mecanismos, que controlam os estoques de nutrientes e que são responsáveis pela ingestão de alimento, regulando a fome (SPINOZA, 2017). A regulação do apetite envolve uma variedade de estruturas do sistema nervoso central, como os núcleos presentes no hipotálamo ventromedial (centro da saciedade) e no hipotálamo lateral (centro da fome). No sistema límbico, regiões importantes para a regulação do apetite incluem o núcleo arqueado (ARC) e o núcleo accumbens (NA) (BLUNDELL, 1991).
Os neurotransmissores envolvidos nos mecanismos de controle de apetite são a histamina, ácido γ-aminobutírico (GABA), serotonina, noradrenalina e dopamina (HALFORD, 2001; FEIJÓ, 2011). Outros sinalizadores do apetite participam da regulação da fome, através de ações orexígenas ou anorexígenas. Exemplos de sinalizadores anorexígenos são a insulina (SILVERSTONE e BESSER, 1971) e o glucagon, produzidos no pâncreas, e a leptina produzida nos adipócitos e no estômago (JEUSETTE et al., 2005; HOENIG et al., 2007). Exemplos de sinalizadores orexígenos são o neuropeptídeo Y (BADO et al., 1998; WEN et al., 1995),o peptídeo relacionado ao agouti (AgRP), produzidos no hipotálamo, e a grelina, produzida no estômago e no hipotálamo (ROMERO, 2006). A figura 1 mostra alguns dos mecanismos envolvidos na regulação do apetite.
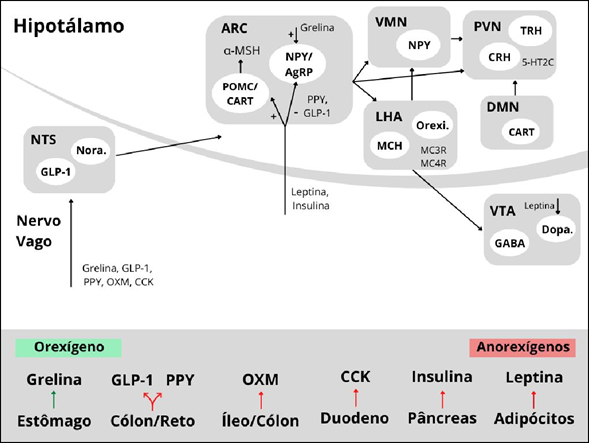
A maioria dos fármacos inibidores de apetite atuam sobre o sistema de apetite. No entanto, nem todos têm seu mecanismo de ação relacionado diretamente à essa regulação. Alguns, por exemplo, reduzem o consumo energético através do bloqueio da absorção de nutrientes, como é o caso do orlistate (HENESS, 2012; HECK, 2000).
O papel das monoaminas, como a serotonina (5-HT), no controle do apetite de humanos é bem estabelecido;os inibidores de apetite de ação central atuam sobre duas vias farmacológicas: via das catecolaminas e via da serotonina. Agonistas de receptores serotoninérgicos (5-HT2C e 5-HT1B) produzem redução da ingestão de alimentos, fome e/ou peso corporal, equivalente a uma ação de aumento de saciedade, através de ação excitatória direta nos centros de fome e saciedade do hipotálamo. No caso da via das catecolaminas, a ação central do inibidor eleva a produção e liberação de noradrenalina e dopamina, o que estimula os núcleos hipotalâmicos laterais e, consequentemente, inibe a fome (HALFORD & JOHN, 2000; SILVERSTONE, 1992).
Seres humanos
A anfetamina foi o primeiro fármaco inibidor de apetite de ação central a ser introduzido no tratamento da obesidade em humanos. Em função de seu efeito estimulante no sistema nervoso central e potencial aditivo, não tem sido prescrita mais para o tratamento. Em contrapartida, fármacos de atividade similar, mas menor potência estimulante, foram desenvolvidos. É o caso da anfepramona, amina simpaticomimética de administração intermitente (meses alternados), muito utilizada em pacientes que sofrem de hipertensão (SEEDAT, 1974; NORRIS, 2005). A fentermina é um outro inibidor de apetite, derivado da feniletilamina e que apresenta mecanismo de ação semelhante ao da anfepramona, também respaldado sobre a via das catecolaminas (RYDER, 2016; BALCIOGLU, 1998). Muito empregado no tratamento da obesidade humana no Brasil, o femproporex é um agente estimulante central simpatomimético que atua na neurotransmissão noradrenérgica e dopaminérgica. No organismo é biotransformado em anfetamina e depois é eliminado. O mazindol, outro inibidor, bloqueia a recaptação da noradrenalina e da dopamina nas terminações nervosas (SWEENEY, 1978).
Já a sibutramina é um fármaco anorexígeno que inibe seletivamente a recaptação de noradrenalina e de serotonina. O seu duplo mecanismo de ação resulta em dois efeitos fisiológicos sinérgicos, uma redução na ingestão de energia e um aumento no gasto de energia, que se combinam para promover e manter a perda de peso (KOROLKOVAS, 2005; HALFORD 2001). Ao contrário das anfetaminas, os metabólitos provenientes do fármaco sibutramina não elevam a liberação de neurotransmissores, como a noradrenalina e a serotonina. No caso, a regulação do apetite e à saciedade são resultados da inibição dos centros serotoninérgicos (KOROLKOVAS, 2005).
Diferentemente dos inibidores de apetite de ação central, o orlistate, derivado sintético da lipistatina, apresenta ação intestinal; a substância atua inibindo de maneira parcial a atividade das lipases gástrica, pancreática e carboxil-éster no trato gastro-intestinal, de forma a reduzir a digestão e absorção de gordura ingerida (GUERCIOLINI, 1997; HECK, 2000). A tabela 1 mostra os principais inibidores de apetite empregados atualmente na medicina humana e veterinária.
Cães e Gatos
No âmbito veterinário, poucos fármacos anorexígenos foram desenvolvidos e aprovados. Seu uso ainda é restrito a certas espécies, como a canina, e pouco difundido e discutido. Há poucas opções e dentre os medicamentos desenvolvidos não existem variedades de mecanismo de ação.
O dirlotapide tem sido a primeira droga “anti-obesidade” canina comercializada. Trata-se de um inibidor da proteína de transferência de triglicerídeo microssomal (MTP) desenvolvido especificamente para perda de peso em cães (KIRK, 2007; WREN, 2007). Seu mecanismo de ação ainda não é completamente elucidado, mas acredita-se que a substância reduz a absorção de gordura pela membrana luminal e colabora para a saciedade, por meio de sinais enviados a partir dos enterócitos cheios de lipídios.
O mitratapide é um medicamento veterinário também utilizado para o tratamento da obesidade canina que, como o dirlotapide, não possui seu mecanismo de ação completamente elucidado. Trata-se de uma substância inibidora da proteína de transferência de triglicerídeo microssomal (MTP) administrada por períodos curtos de 2-3 semanas, o que contrasta com o uso contínuo do dirlotapide (GERMAN, 2010; DOBENECKER,2009).
Considerações finais
Não há consenso na utilização de inibidores de apetite na prática clínica. Os benefícios dos inibidores de apetite à saúde a longo prazo permanecem ainda sem comprovação. No entanto, apesar de grande interesse, trata-se de um assunto pouco discutido e explorado na medicina veterinária. A utilização de inibidores de apetite de maneira coadjuvante ao tratamento da obesidade em cães e gatos pode se mostrar extremamente benéfico, principalmente quando se considera o caráter multifatorial da obesidade e, ainda, falha em outras abordagens utilizadas no tratamento da doença.
Torna-se assim extremamente necessária a realização de ensaios clínicos específicos, avaliando a verdadeira empregabilidade dos fármacos já existentes nos animais de companhia e, de maneira análoga, estudos que explorem a eficácia da utilização de tais fármacos no tratamento da obesidade.
Referências bibliográficas
ABESO. Atualização das Diretrizes para o Tratamento Farmacológico da Obesidade e do Sobrepeso, 2010.
ANDERSON, R.S. Obesity in the dog and cat. Blackwell Scientific Publictions, p. 182-186, 1973.
BADO, A., CLOAREC, D., MOIZO, L., LAIGNEAU, J.P., BATAILLE, D, LEWIN,
M.J. Neurotensin and oxyntomodulin-(30-37) potentiate PYY regulation of gastric acid and somatostatin secretions. American Journal of Physiology, v. 265, p.113–117, 1993.
BALCIOGLU, A.; WURTMAN, R.J. Effects of phentermine on striatal dopamine and serotonin release in conscious rats: In vivo microdialysis study. International Journal of Obesity, v. 22, p.325-328, 1998.
BERLEZE, L. Termogênicos: Um ponto de partida para o desenvolvimento de novos fármacos anti obesidade. Trabalho de conclusão de curso, Faculdade de Farmácia, Universidade federal do Rio Grande do Sul, 2013.
BLUNDELL, J.E. Pharmacological approaches to appetite suppression. Trends Pharmacol Sciences, v.12(4), p.147-157, 1991.
BLUNDELL, J. E.; LATHAM, C. J.; MONIZ, E.; MCARTHUR, R. A. & ROGERS, P.
- Structural analysis of the actions of amphetamine and fenfluramine on food intake and feeding behaviour in animals and in man, Current Medical Research and Opinion, v.6(1), p. 34-54, 1979.
BRAY G Drug therapy of obesity. Official reprint from upToDate® , www.uptodate.com, 2010.
BRUNETTO, M. A.; NOGUEIRA, S.; SÁ, F. C.; PEIXOTO, M.; VASCONCELLOS,
- S.; FERRAUDO, A. J.; CARCIOFI, A. C. Correspondência entre obesidade e hiperlipidemia em cães. Ciência Rural, v. 41, p. 266-271, 2011.
BRUNETTO, M. A.; SÁ, F. C.; NOGUEIRA, S. P.; GOMES, M. D. O. S.; PINAREL,
- G.; JEREMIAS, J. T.; PAULA, F. J. A.; CARCIOFI, A. C. The intravenous glucose tolerance and postprandial glucose tests may present different responses
in the evaluation of obese dogs. British Journal of Nutrition, v. 106, p. 194-197, 2011.
CRAIGHEAD, L.W.; STUNKARD, A.J.; O’BRIEN, R.M. Behavior therapy and
pharmacotherapy for obesity. Arch Gen Psychiatry, v. 38(7), p.763-768, 1981.
DOBENECKER, B. DE BOCK, M., ENGELEN, M. et al. Effect of mitratapide on body composition, body measurements and glucose tolerance in obese Beagles. Veterinary Research Communications, v.33, p.839-847, 2009.
FAZENDA, M. I. N.Estudo da relação entre a obesidade e a hipertensão em cães. Faculdade de Medicina Veterinária. Universidade Técnica de Lisboa, Lisboa, 2010.
FEIJO, F.M.; BERTOLUCI, M.C.; REIS, C. Serotonina e controle hipotalâmico da fome: uma revisão. Revista da Associação Médica Brasileira, v. 57, n. 1, p. 74-77, 2011.
GARFIELD A.S.; HEISLER, L.K. Pharmacological Targeting of the Serotonergic System for the Treatment of Obesity. Journal of Physiology, v. 587(1), p.49-60, 2009.
GERMAN, A.J. The growing problem of obesity in dogs and cats. Journal of Nutrition, v.136, p.1940-1946, 2006.
GERMAN, A.J. Obesity in companion animals. Journal of Nutrition, v.136, p.1940 -1946, 2010.
GERMAN, A.J. Obesity in companion animals. Companion Animal Practice, v. 32, p. 42-50, 2010.
GERMAN, A.J. Obesity Prevention and Weight Maintenance After Loss Veterinary Clinics of North America: Small Animal Practice, v. 46 , p.913–929, 2016.
GUERCIOLINI, R. Mode of action of orlistat. International & Related Metabolic Disorders, v. 3, p. 12-23, 1997.
GÓMEZ-SILVA, M.; PIÑEYRO-GARZA, E.; VARGAS-ZAPATA, R. et al.
Pharmacogenetics of amfepramone in healthy Mexican subjects reveals potential markers for tailoring pharmacotherapy of obesity: results of a randomised trial. Sci Rep 9, 17833, 2019.
GREENWOOD, H.C., BLOOM, S.R., MURPHY, K.G. Peptides and their potential role in the treatment of diabetes and obesity. TheReview Diabetic Studies, v. 8, p. 355-368, 2011.
HALFORD, J.C. Pharmacology of appetite suppression: implication for the treatment of obesity. Current Drug Targets, v. 2(4), p.353-370, 2001.]HALFORD,
HALFORD, J.C. & BLUNDELL, J. Separate systems for serotonin and leptin in appetite control, Annals of Medicine, v. 32 (3), p.222-232, 2000.
HECK, A.M.; YANOVSKI, J.A.; CALIS, K.A. Orlistat, a New Lipase Inhibitor for the Management of Obesity. Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy, v.20, p.270-279, 2000.
HENNESS, S.; PERRY, C.M. Orlistat. Drugs, v. 66, p.1625-1656, 2006.
HOENIG, M., THOMASETH, K., WALDRON, M., FERGUSON, D.C. nsulin
sensitivity, fat distribution, and adipocytokine response to different diets in lean and obese cats before and after weight loss. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, v.292, p.227–234, 2007.
HOMMEL, J.D.; TRINKO, R.; SEARS, R.M.; GEORGESCU, D.; LIU, Z.W.; GAO,
X.B.; THURMON, J.J.; MARINELLI, M.; DILEONE, R.J. Leptin receptor signaling in midbrain dopamine neurons regulates feeding. Neuron, v. 51, p.801-810, 2006.
JAMES, W.P.; ASTRUP, A.; FINER, N.; HILSTED, J.; KOPELMAN, P.;
RÖSSNER, S., et al. Effect of sibutramine on weight maintenance after weight loss: a randomised trial. Lancet, v.356, p.2119-2125, 2000.
JEUSETTE, I.C., LHOEST, E.T., ISTASSE, L.P., DIEZ, M.O. Influence of obesity
on plasma lipid and lipoprotein concentrations in dogs. American Journal of Veterinary Research, v.66, p.81–86, 2005.
KANKAANPAA, A., MERIRINNE, E. & SEPPÄLÄ, T. 5-HT3 receptor antagonist MDL 72222 attenuates cocaine- and mazindol-, but not methylphenidate-induced neurochemical and behavioral effects in the rat. Psychopharmacology, v.159, p. 341–350, 2002.
KIRK, C.A., BOUCHER, J.F., SUNDERLAND, S.J. and WREN, J.A. Influence of
dirlotapide, a microsomal triglyceride transfer protein inhibitor, on the digestibility of a dry expanded diet in adult dogs. Journal of Veterinary Pharmacology and Therapeutics, v. 30, p. 66-72, 2007.
KOPELMAN, PG. Obesity as a medical problem. Nature, v. 404, p. 635-643, 2000.
KOROLKOVAS, A. Dicionário Terapêutico Guanabara. 12. ed. Rio de Janeiro: Guanabara Koogan, 2005-2006.
LAFLAMME, D.P. Companion Animals Symposium: Obesity in dogs and cats: what is wrong with being fat? Journal of Animal Science, v. 90, p.1653–1662, 2011.
LENARD, N.R.; BERTHOUD, H.R. Central and peripheral regulation of food intake and physical activity: pathways and genes. Obesity (Silver Spring), v.16 (3), p.11-22, 2008.
LEAN, M. How does sibutramine work?. International Journal of Obesity, v. 25, p.8-11, 2001.
LI Z.; MAGIONE, M.; TU, W.; MOJICA, W.; ARTERBURN, D.; SHUGARMAN, L.R.; HILTON, L.; SUTTORP, M.; SOLOMAN, V.; SHEKELLE, P.G.; MORTON, S.
Meta-analysis: Pharmacologic treatment of obesity. Annals of Internal Medicine, v.142, p.532-546, 2005.
LINDER, D. & MUELLER, M. Pet obesity management: beyond nutrition.
Veterinary Clinics: Small Animal Practice, v. 44, p. 789-806, 2014.
LUND, E.M.; JANE ARMSTRONG, P., KIRK, C.A., KLAUSNER, J.S. Prevalence
and risk factors for obesity in adult dogs from private US Veterinary Practices.
International Journal of Applied Research Veterinary Medical, v.4, p.177-186, 2006.
MALONE, M.; ALGER-MAYER, S.A. Pharmacist intervention enhances adherence to orlistat therapy. Annals of Pharmacotherapy, v.37, p.1598-1602, 2003.
MCGREEVY, P.D; THOMSON, P.C.; PRIDE, C., FAWCETT, A.; GRASSI, T.;
JONES, B. Prevalence of obesity in dogs examined by Australian veterinary practices and the risk factors involved. Vet Rec., v.156, p. 695-707, 2005.
MCCRORY, M.A. FUSS, P.J., SALTZMAN, E., ROBERTS, S.B. Dietary
determination of energy intake and weight regulation in healthy adults. Journal of Nutrition, v.130(2), p.276-279, 2000.
MUNZBERG, H. Leptin-signaling pathways and leptin resistance. Forum of Nutrition, v. 63, p.123-132, 2010.
NISOLI, E., CARRUBA, M.O. An assessment of the safety and efficacy of sibutramine, an anti-obesity drug with a novel mechanism of action. Obesity Reviews, v.1(2), p.127-139, 2000.
NORRIS, S.L.; ZHANG, X.; AVENELL, A.; GREGG, E.; SCHMID, C.H.; LAU, J.
Pharmacotherapy for weight loss in adults with type 2 diabetes mellitus. Cochrane Database of Systematic Reviews, v.25 (1), 2005.
OSTO, M.; LUTZ, T. A. Translational value of animal models of obesity – Focus on dogs and cats. European Journal of Pharmacology, v. 759, p. 240-252, 2015.
PEREIRA-NETO, G. B., BRUNETTO, M. A., OBA, P. M., CHAMPION, T., VILLAVERDE, C., VENDRAMINI, T. H. A., BALIEIRO, J. C. C., CARCIOFI, A. C. ;
CAMACHO, A. A. Weight loss improves arterial blood gases and respiratory parameters in obese dogs. Journal of Animal Physiology and Animal Nutrition, v. 102, p. 1743-1748, 2018.
PEREIRA-NETO, G. B.; BRUNETTO, M. A.; SOUSA, MARLOS G.; CARCIOFI, A.
C.; CAMACHO, A. A. Effects of weight loss on the cardiac parameters of obese dogs. Pesquisa Veterinária Brasileira, v. 30, p. 167-171, 2010
RYDER, J.; KAIZER, A.; RUDSER, K. et al. Effect of phentermine on weight reduction in a pediatric weight management clinic. International Journal of Obesity, v.41, p.90–93, 2017.
ROMERO, C.E.M.; ZANESCO, A. O papel dos hormônios leptina e grelina na gênese da obesidade. Revista de Nutrição, v. 19(1), p. 85-91, 2006 .
SAHU, A. Leptin signaling in the hypothalamus: emphasis on energy homeostasis and leptin resistance. Frontiers in Neuroendocrinology, v.24, p.225-253, 2003.
SCARLETT, J.M.; DONOGHUE, S.; SAIDLA, J.; WILLS, J.Overweight cats:
prevalence and risk factors. Int J Obes Relat Metab Disord., v.18, p. 22-28, 1994.
SCHEEN, A.J.; LEFÉBVRE, P.J. Pharmacological treatment of obesity: present status. International Journal of Obesity, v. 23(1), p.47-53, 199.
SEEDAT, Y.K.; REDDY, J. Diethylpropion hydrochloride (Tenuate Dospan) in combination with hypotensive agents in the treatment of obesity associated with hypertension. Current Therapeutic Research, Clinical and Experimental, v.16, p.398-4013, 1974.
SILVA, L.P.S; JUNIOR, R.C.H.N; PEREIRA, C.MC; BERNARDINO, V.M, P.
Manejo nutricional para cães e gatos obesos. PUBVET, v.13 (5), p.1-12, 2019.
SILVA, R.S.F.; BRITO, A.K.F.; FREIRE, B.A.A.; SOUSA, L.M.; PEREIRA, I.M.
Obesidade canina: Revisão. PUBVET, v.11, n.4, 371-380, 2017.
SILVERSTONE, T. Appetite suppressants. A review. Drugs, v. 43, p. 820-836, 1992.
SLOTH, C.. Practical management of obesity in dogs and cats. J Small Anim Pract; v. 33, p.178-182, 1992.
Sociedade Brasileira de Endocrinologia e Metabologia, Sociedade Brasileira de Clínica Médica, Sociedade Brasileira de Medicina da Família e Comunidade, Sociedade Brasileira de Nutrição Parenteral e Enteral, Associação Brasileira de Nutrologia. Obesidade e Sobrepeso: Tratamento Farmacológico. Projeto Diretrizes. Associação Médica Brasileira e Conselho Federal de Medicina, 2010.
SPINOSA, Helenice de Souza; GÓRNIAK, Silvana Lima; BERNARDI, Maria Martha. Farmacologia aplicada à medicina veterinária, 6º edição, Editora Guanabara, Rio de Janeiro, 2011.
SWEENEY, K.F. The anorectic action of mazindol. Irish Journal of Medical Science, v.147, p.66–70, 1978.
ULLRICH, A.; ERDMANN, J.; MARGRAF, J.; SCHUSDZIARRA, V. Impact of
carbohydrate and fat intake on weight-reducing efficacy of orlistat. Alimentary Pharmacology Therapies, v.17, p.1007-1013, 2003.
VAN GESTEL, M.A; KOSTRZEWA, E.; ADAN, R. A. H.; JANHUNEN, S.K.
Pharmacological manipulations in animal models of anorexia and binge eating in relation to humans. British journal of pharmacology, v.171 (20), p. 4767-4784, 2014.
VENDRAMINI, T. H. A., MACEDO, H. T., RENTAS, M. F., AMARAL, A, R, MACEGOZA, M. V., PFRIMER, K., PONTIERI, C. F.F., PEDREIRA, R., BALIEIRO, J. C. C., GOMES, C. O. M. S., BRUNETTO, M. A. Gene expression
of immunoinflammatory response and immunological status in obese dogs before and after weight loss. Proceedings of 24th Congress of the European Society of Veterinary and Comparative Nutrition, 2019.
WREN, J.A., KING, V.L., CAMPBELL, S.L. and HICKMAN, M.A., Biologic activity
of dirlotapide, a novel microsomal triglyceride transfer protein inhibitor, for weight loss in obese dogs. Journal of Veterinary Pharmacology and Therapeutics, v. 30, p.33-42, 2007.
WREN, J.A.; GOSSELLIN, J.; SUNDERLAND, S.J. Dirlotapide: a review of its properties and role in the management of obesity in dogs. Journal of Veterinary Pharmacology and Therapeutics, v.30: p.11-16, 2007.
YU, J.H.; KIM, M.S. Molecular mechanisms of appetite regulation. Diabetes & Metabolism Journal, v. 36(6), p. 391-398, 2012.
ZHI, J.; MELIA, A.T.; FUNK, C.; et al. Metabolic profile of minimally absorbed orlistat in obese/overweight volunteers. Journal of Clinical Pharmacology, v.36, p.1006-1011, 1996.
ZORAN, D. L. Obesity in dogs and cats: A metabolic and endocrine disorder. Veterinary Clinics of North America: Small Animal Practice, v. 40, p. 221-239, 2010.






