Orientador(a): Márcia de Oliveira Sampaio Gomes
Instituição: Universidade de São Paulo
Trabalho Classificado na 10ª Edição (2024) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
Neste estudo foi realizada uma meta-análise com objetivo de comparar os efeitos do consumo do frutoligossacarídeo (FOS), galactomananoligossacarídeo (GGMO), galactologossacarídeo (GOS), inulina (IN), mananoligossacarídeo (MOS) e parede celular de levedura (PCL). O objetivo foi comparar os resultados de FOS como valor de referência com os prebióticos, de acordo com as doses e efeitos na nutrição de cães. Os parâmetros avaliados foram: coeficiente de digestibilidade aparente (CDA%) da matéria seca (MS), proteína bruta (PB), extrato etéreo (EE), ácidos graxos de cadeia curta (mmol/Kg na MS) nas concentrações de acetato, propionato, butirato, totais (AGCC totais) e as contagens das unidades formadoras de colônias (log10 UFC/g na MS) de Bifidobacterium spp., Lactobacillus spp., Escherichia coli e Clostridium perfringens. O banco de dados do estudo foi coletado em plataforma de pesquisa (Embase e PubMed) e foram incluídos artigos científicos dos últimos 35 anos, de 1998 à 2023. Foram utilizados 15 estudos com animais saudáveis, de diversas raças, cães adultos, no período experimental de 10 a 60 dias. As variáveis foram consideradas significativas quando p≤0,05. Na variável MS a média foi 81,80%, na PB foi analisado um valor de média de 81,31, em EE foi 93,84. Na variável MS e EE a dose foi significativa com p=0,040 e p=0,016, respectivamente. O GGMO (p<0,0001), GOS (p=0,002), e PCL (p=0,030) aumentaram a digestibilidade do EE em comparação com o valor de referência FOS. Nos resultados da microbiota diminuiu Bifidobacterium spp. com o tratamento GGMO (p=0,040). E. coli foi a única variável com resultado significativo em resposta ao tempo sendo p=0,048, e diminuiu comparado a FOS. E também foi observado valor significativo para FOS+MOS (p=0,009), com resultado inferior a referência. Os dados sobre Lactobacillus spp. com tratamento PCL foi significativo p=0,045. Todas as análises meta-analíticas descritivas e meta-regressão foram realizadas com a utilização dos procedimentos no programa estatístico R (pacote Metafor, versão 3.4.2). Assim conclui-se que a dose de inclusão dos prebióticos influencia no CDA da MS e do EE. Há diferença na modulação da microbiota intestinal de acordo com dose, que promove aumento de bactérias benéficas Bifidobacterium spp. e Lactobacillus spp. e tempo, que há redução de E. coli.
Introdução
A inclusão de prebióticos na nutrição de cães apresenta benefícios à saúde intestinal ao estimular o crescimento e ativar o metabolismo de grupos de bactérias no trato gastrointestinal (kroll et al., 2020). Dentre eles estão os FOS, prebióticos mais estudados, pela capacidade de influenciar na modulação do microbioma e selecionarem as bactérias (Pinna et al., 2018). Já GGMO apresenta potencial prebiótico por resistir à digestão hidrolítica, e por ser altamente fermentável (Faber et al., 2011). A inclusão de GOS demonstra possível estimulo na proliferação de Bifidobacterium no cólon, que suprimem a atividade de bactérias putrefativas (Pinna e Biagi, 2014; Perini et al., 2020). Já a IN pode ter efeitos positivos na regularidade do trânsito intestinal, imunidade e microbiota (Swanson et al., 2002; Fahey et al., 2004). Os prebióticos MOS são derivados da PCL, que têm capacidade de se ligar a bactérias patogênicas no intestino, e prevenir sua aderência à mucosa intestinal (Grieshop et al., 2004; Lin et al., 2019). Já a parede celular é uma fonte de compostos bioativos, β-glucanos e MOS, que pode fortalecer a barreira intestinal, reduzir a permeabilidade intestinal e a translocação bacteriana (Theodoro et al., 2019). O objetivo do estudo foi realizar uma meta-análise sobre os efeitos dos prebióticos no CDA da MS, PB, EE, produtos de fermentação e microbiota fecal de cães adultos saudáveis.
Material e métodos
Uma meta-análise comparativa foi realizada sobre os efeitos dos prebióticos no CDA da MS, PB, EE, concentrações de acetato, propionato e butirato, AGCC totais, contagens de unidades formadoras de colônias (log10 UFC/g na MS) de Bifidobacterium spp., Lactobacillus spp., Escherichia coli e Clostridium perfringen. Os artigos foram pesquisados nas plataformas Embase e PubMed, período de 1998 a 2023, pesquisados até agosto de 2023. Foram incluídos estudos com cães saudáveis, adultos, com dose de administração, adicionados por extrusão, cápsula ou pó. Trabalhos com uso de ração ou alimentação caseira, testagem de um ou dois ingredientes, de 10 a 60 dias, experimento in vivo, com coeficiente de digestibilidade do trato gastrointestinal total das fezes. Na análise meta-analítica foi utilizado o programa estatístico R (Pacote Metafor, Versão 3.4.2).
Ao avaliar o efeito, modelos fixos ou aleatórios, foram utilizados, dependendo da heterogeneidade entre o grupo FOS e os grupos FOS+MOS, GGMO, GOS, IN, MOS e PCL (medida de efeito). Na verificação da presença de heterogeneidade sem efeito do tratamento, foi utilizado o teste Qui-quadrado (Q) e a estatística I2, que quantifica a porcentagem de variação (Higgins et al., 2002). Foi realizada análise de meta-regressão para investigar os efeitos de covariáveis tanto categóricos quanto contínuos, porém conduzida somente com heterogeneidade dos dados. Foi empregado modelo misto de meta-regressão, considerando a DM como variável dependente. Utilizou-se o R2 ajustado para indicar a proporção da heterogeneidade (Harbord e Higgins, 2008; Viechtbauer, 2010).
Resultados
Foram utilizados 15 artigos para a análise dos dados (Tabela 1), com inclusões entre 0,25% e 8,00% na MS, e o tempo de administração foi de 10 a 56 dias. Na análise descritiva (Tabela 2) dos estudos ao avaliar o coeficiente de digestibilidade (MS, PB, EE) apresenta os valores referentes ao mínimo, máximo, amplitude, média, mediana e desvio padrão (DP). De acordo com a inclusão dos prebióticos observou-se que a média da MS 81,80%, de PB 81,31, e do EE 93,84. Nos produtos de fermentação (acetato, propionato, butirato) na MS o acetato apresentou média 289,44, o propionato 120,10, e o butirato 54,26.
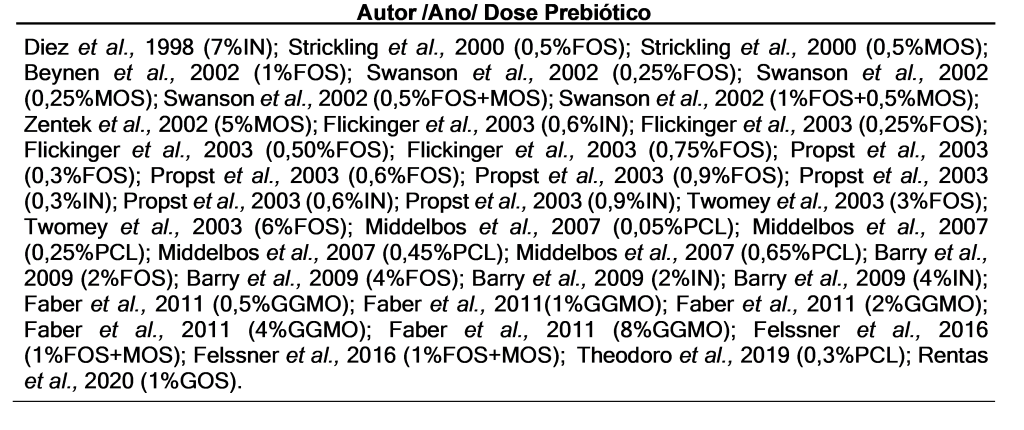
Ao descrever os dados de microbiota fecal Bifidobacterium spp., C. perfringens, E. coli e Lactobacillus spp., foi obtido Bifidobacterium spp. da média 9,21, C. perfringens de 9,09. E. coli de 9,47, Lactobacillus spp. de 10,33. Já na análise de meta-regressão (Tabela 3) os resultados foram comparados FOS versus os tratamentos FOS+MOS, GGMO, GOS, IN, MOS, PCL, e o resultado foi considerado significativo quando p≤0,05. Na variável MS a dose foi significativa p= 0,040, e GGMO teve o valor de p=0,001, para EE comparando a dose p=0,016. O GGMO (p<0,0001), GOS (p=0,002), e PCL (p=0,030) significativos. Já os produtos de fermentação, o butirato foi p=0,0002 na inclusão de FOS+MOS. Nas análises de AGCC totais o FOS+MOS o p=0,044.

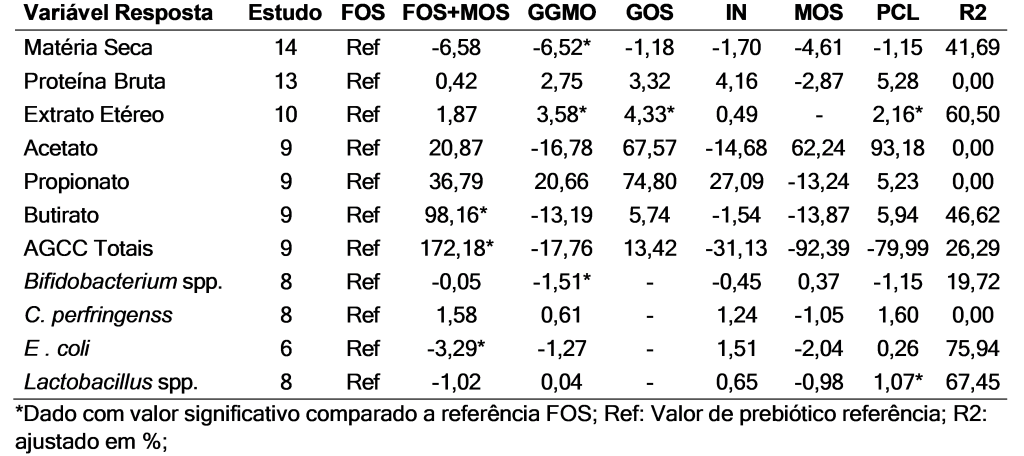
Em relação aos resultados da microbiota para Bifidobacterium spp. o GGMO foi significativo (p=0,0406). Nos dados apresentados a E. coli foi a única variável com resultado significativo em resposta ao tempo sendo p=0,048. E também foi observado valor significativo para FOS+MOS (p=0,0094), sobre os Lactobacillus spp. no tratamento PCL valor de p=0,045.
Discussão
Na análise dos resultados de CDA na MS foi menor com 0,25% MOS, e maior 0,30% FOS. Nos dados sobre PB menor valor foi no 6,00% FOS, e maior em 4,00% IN. Estes valores reduzidos na digestibilidade da MS e PB são semelhantes ao trabalho de Zentek et al. (2002) em cães suplementados com 5,00% de MOS, durante 10 dias. Essa redução na digestibilidade da PB pode ser resposta a síntese proteica microbiana no intestino grosso (Middelbos et al., 2007). Na análise de EE a menor digestibilidade comparada à média foi com IN na dose de 0,60%. Isto pode ser atribuída à sua elevada solubilidade e fermentabilidade, que pode interferir na absorção de gordura em cães (De-Oliveira et al., 2012).
Nos produtos de fermentação, tanto o acetato, propionato, quanto os AGCC totais apresentaram valores menores para 2,00% IN e maior para 0,60% IN. A redução na produção de acetato, propionato e AGCC totais podem estar relacionados a sua rápida absorção pelas vilosidades intestinais (Stercova et al., 2016). Como foi constatado pelos estudos de Swanson et al. (2002) com cães, que não houve aumento da concentração de AGCC. Esta mesma relação é válida para o estudo com 0,25% FOS que apresentou um valor baixo para butirato. As evidências científicas demonstram que o butirato além de auxiliar na nutrição e manutenção das vilosidades pode ajudar a reduzir a inflamação (Theodoro et al., 2019). Já valores superiores para os AGCC totais corroboram com Panasevich et al. (2021), que os frutanos com menor grau de polimerização terão maior fermentabilidade no intestino grosso proximal, enquanto os frutanos com maior grau de polimerização, como a IN, fermentarão por mais tempo.
Em relação a modulação da microbiota os resultados obtidos para Bifidobacterium spp., o menor valor foi com a inclusão de 2% GGMO, e maior para 0,50% FOS. Devido a composição de GGMO fatores como a taxa de trânsito, a composição do substrato e interações microbianas podem influenciar em menor seletividade de Bifidobacterium spp. (Scott et al., 2015). Já no tratamento de 0,50% FOS, os resultados são similares a pesquisas que afetaram microbiota intestinal, estimulando o crescimento de bifidobactérias (Barry et al., 2009). Outro estudo avaliou efeito de FOS na microbiota de cães saudáveis, administrado por 16 dias, e houve aumento significativo de Bifidobacterium spp. (Garcia-Mazcorro et al., 2017). Nos dados sobre C. perfringens, a dose de prebiótico menor foi 0,50% MOS e maior com 0,65% PCL. Em menor dose o estudo de Middelbos et al. (2007) apresentou redução de C. perfringens, a qual foi atribuída os níveis de MOS na PCL. O aumento de bactérias patogênicas pode ser influenciado pela fonte e quantidade de proteína dietética (Zentek et al., 2003). O resultado para E. coli foi menor com 0,50%MOS. Semelhante ao resultado de Gouveia et al. (2006) com 16 cães, que constatou efetividade de 2g/animal de MOS. Isso pode estar correlacionado ao fato da E. coli ser incapazes de fermentar MOS, podendo ter seu crescimento reduzido (Gouveia et al., 2006). Para os Lactobacillus spp. foi menor com 0,25% de FOS e maior com 0,45% de PCL. A presença dos Lactobacillus spp. pode ser fisiologicamente importante, minimizando distúrbios gastrointestinais (Gibson et al., 2004).
Nos dados na meta-regressão, na digestibilidade da MS houve influência da dose, que provavelmente está relacionado a solubilidade, e absorção pelo intestino. Na MS o GGMO foi maior que FOS, isto pode ser consequência da solubilidade do prebiótico. No EE a dose apresentou diferentes resultados entre os tratamentos, e corrobora com trabalhos em cães, com redução da digestibilidade de EE, devido o comportamento do prebiótico (Theodoro et al., 2019). O valor do butirato e os AGCC totais foram maiores para FOS+MOS em comparação com FOS, como encontrados em outros estudos com prebióticos (Panasevich et al., 2021). Para E. coli o tempo influenciou, e FOS+MOS teve um valor menor de E. coli, provavelmente, há relação com a ação da junção dos prebióticos. Segundo Willard et al. (2000) em experimento com 6 cães, a utilização de FOS aumentou Bifidobacterium spp. e Lactobacillus spp., já Clostridium spp. e E coli não apresentaram alterações. Em geral mais prebióticos apresentam maior efeito microbiota, produtos fermentativos, e sistema imuni (Panasevich et al., 2021).
Conclusão
A dose de inclusão dos prebióticos influencia no CDA da MS e do EE. Há diferença na modulação da microbiota intestinal entre as inclusões dos prebióticos com aumento de bactérias benéficas Bifidobacterium spp. e Lactobacillus spp. em suas comparações. O tempo de uso do prebiótico tem efeito de redução da E. coli, que beneficia a saúde intestinal de cães adultos.
Referências bibliográficas
BARRY, K. A.; HERNOT, D. C.; MIDDELBOS, I. S.; FRANCIS, C.; DUNSFORD, B.; SWANSON, K. S.; FAHEY JR, G. C. Low-level fructan supplementation of dogs enhances nutrient digestion and modifies stool metabolite concentrations, but does not alter fecal microbiota populations. Journal of animal science, v. 87, n. 10, p. 3244-3252, 2009.
BEYNEN, A. C.; BAAS, J. C.; HOEKEMEIJER, P. E.; KAPPERT, H. J.; BAKKER, H.; KOOPMAN, J. P.; LEMMENS, A. G. Faecal bacterial profile, nitrogen excretion and mineral absorption in healthy dogs fed supplemental oligofructose. Journal of Animal Physiology and Animal Nutrition, v. 86, n. 9‐10,
- 298-305, 2002.
DE‐OLIVEIRA, L. D. et al. Fibre analysis and fibre digestibility in pet foods–a comparison of total dietary fibre, neutral and acid detergent fibre and crude fibre. Journal of animal physiology and animal nutrition, v. 96, n. 5, p. 895-906, 2012.
DIEZ, M.; HORNICK, J. L.; BALDWIN, P.; VAN EENAEME, C.; ISTASSE, L. The
influence of sugar-beet fibre, guar gum and inulin on nutrient digestibility, water consumption and plasma metabolites in healthy Beagle dogs. Research in veterinary science, v. 64, n. 2, p. 91-96, 1998.
FABER, T. A.; HOPKINS, A. C.; MIDDELBOS, I. S.; PRICE, N. P.; FAHEY JR, G. Galactoglucomannan oligosaccharide supplementation affects nutrient digestibility, fermentation end-product production, and large bowel microbiota of the dog. Journal of animal science, v. 89, n. 1, p. 103-112, 2011.
FAHEY, G. C.; FLICKINGER, E. A.; GRIESHOP, C. M.; E SWANSON, K. S. The
role of dietary fibre in companion animal nutrition. In: Dietary fibre. Wageningen Academic, 2004. p. 295-328.
FELSSNER, K.; TODESCO, H.; GRANDE, P. A.; OGOSHI, R. C. S.; DOS REIS, J. S.; SAAD, F. M. D. O. B.; VASCONCELLOS, R. S. Dietetic combination of mannan- oligosaccharides and fructooligosaccharides modifies nitrogen metabolism in dogs. Semina: Ciências Agrárias, v. 37, n. 5, p. 3335-3347, 2016.
FLICKINGER, E. A.; SCHREIJEN, E. M. W. C.; PATIL, A. R.; HUSSEIN, H. S.; GRIESHOP, C. M.; MERCHEN, N. R.; FAHEY JR, G. C. Nutrient digestibilities, microbial populations, and protein catabolites as affected by fructan supplementation of dog diets. Journal of animal science, v. 81, n. 8, p. 2008-2018, 2003.
GARCIA-MAZCORRO, J. F.; BARCENAS-WALLS, J. R.; SUCHODOLSKI, J. S.; STEINER, J. M. Molecular assessment of the fecal microbiota in healthy cats and dogs before and during supplementation with fructo-oligosaccharides (FOS) and inulin using high-throughput 454-pyrosequencing. PeerJ, v. 5, p. e3184, 2017.
GIBSON, G. R.; PROBERT, H. M.; VAN LOO, J.; RASTALL, R. A.; ROBERFROID, B. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutrition research reviews, v. 17, n. 2, p. 259-275, 2004.
GOUVEIA, E. M. F.; SILVA, I. S.; VAN ONSELEM, V. J.; CORRÊA, R. A. C.; SILVA, J. Use of mannanoligosacharides as an adjuvant treatment for gastrointestinal diseases and this effects on E. coli inactivated in dogs. Acta Cirúrgica Brasileira,
- 21, p. 23-26, 2006.
GRIESHOP, C.; FLICKINGER, E.; BRUCE, K.; PATIL, A. R.; CZARNECKI – MAULDEN, G. L.; FAHEY JR, G. C. Gastrointestinal and immunological responses of senior dogs to chicory and mannan-oligosaccharides. Archives of animal nutrition, v. 58, n. 6, p. 483-494, 2004.
HARBORD, R. M.; HIGGINS, J. P. Meta-regression in Stata. The Stata Journal, v. 8, n. 4, p. 493-519, 2008.
HIGGINS, J.P.T; THOMPSON, S.G. Quantifying heterogeneity in a meta‐ analysis. Statistics in medicine, v. 21, n. 11, p. 1539-1558, 2002.
KROLL, F. S. A.; PUTAROV, T. C.; ZAINE, L.; VENTURINI, K. S.; AOKI, C. G.; SANTOS, J. P. F.; CARCIOFI, A. C. Active fractions of mannoproteins derived from yeast cell wall stimulate innate and acquired immunity of adult and elderly dogs. Animal feed science and technology, v. 261, p. 114392, 2020.
LIN, C. Y.; ALEXANDER, C.; STEELMAN, A. J.; WARZECHA, C. M.; DE GODOY, R.; SWANSON, K. S. Effects of a Saccharomyces cerevisiae fermentation product on fecal characteristics, nutrient digestibility, fecal fermentative end- products, fecal microbial populations, immune function, and diet palatability in adult dogs. Journal of animal science, v. 97, n. 4, p. 1586-1599, 2019.
MIDDELBOS, I. S.; GODOY, M. R.; FASTINGER, N. D.;FAHEY JR, G. C. A dose-
response evaluation of spray-dried yeast cell wall supplementation of diets fed to adult dogs: effects on nutrient digestibility, immune indices, and fecal microbial populations. Journal of Animal Science, v. 85, n. 11, p. 3022-3032, 2007.
PANASEVICH, M. R.; DARISTOTLE, L.; QUESNELL, R.; REINHART, G. A.; FRANTZ, N. Z. Altered fecal microbiota, IgA, and fermentative end-products in adult dogs fed prebiotics and a nonviable Lactobacillus acidophilus. Journal of Animal Science, v. 99, n. 12, p. skab347, 2021.
PERINI, M. P.; RENTAS, M. F.; PEDREIRA, R.; AMARAL, A. R.; ZAFALON, R. V.; RODRIGUES, R. B.; BRUNETTO, M. A. Duration of prebiotic intake is a key-factor for diet-induced modulation of immunity and fecal fermentation products in dogs. Microorganisms, v. 8, n. 12, p. 1916, 2020.
PINNA, C.; BIAGI, G. The utilisation of prebiotics and synbiotics in dogs. Italian Journal of Animal Science, v. 13, n. 1, p. 3107, 2014.
PINNA, C.; VECCHIATO, C. G.; BOLDUAN, C.; GRANDI, M.; STEFANELLI, C.; WINDISCH, W.; BIAGI, G. Influence of dietary protein and fructooligosaccharides
on fecal fermentative end-products, fecal bacterial populations and apparent total tract digestibility in dogs. BMC veterinary research, v. 14, n. 1, p. 1-10, 2018.
PROPST, E. L.; FLICKINGER, E. A.; BAUER, L. L.; MERCHEN, N. R.; FAHEY JR C. A dose-response experiment evaluating the effects of oligofructose and inulin on nutrient digestibility, stool quality, and fecal protein catabolites in healthy adult dogs. Journal of animal science, v. 81, n. 12, p. 3057-3066, 2003.
RENTAS, M. F.; PEDREIRA, R. S.; PERINI, M. P.; RISOLIA, L. W.; ZAFALON, R. A.; ALVARENGA, I. C.; BRUNETTO, M. A. Galactoligosaccharide and a prebiotic blend improve colonic health and immunity of adult dogs. PLoS One, v. 15, n. 8, p. e0238006, 2020.
SCOTT, K. P.; JEAN-MICHEL, A.; MIDTVEDT, T.; VAN HEMERT, S. Manipulating
the gut microbiota to maintain health and treat disease. Microbial ecology in health and disease, v. 26, n. 1, p. 25877, 2015.
STERCOVA, E.; KUMPRECHTOVA, D.; AUCLAIR, E.; NOVAKOVA, J. Effects of
live yeast dietary supplementation on nutrient digestibility and fecal microflora in beagle dogs. Journal of Animal Science, v. 94, n. 7, p. 2909-2918, 2016.
STRICKLING, J. A.; HARMON, D. L.; DAWSON, K. A.; GROSS, K. L. Evaluation of
oligosaccharide addition to dog diets: influences on nutrient digestion and microbial populations. Animal feed science and technology, v. 86, n. 3-4, p. 205-219, 2000.
SWANSON, K.; GRIESHOP, C.; FLICKINGER, E.; HEALY, H. P.; DAWSON, K. A.; MERCHEN, N. R.; FAHEY JR, G. C. Effects of supplemental fructooligosaccharides plus mannanoligosaccharides on immune function and ileal and fecal microbial populations in adult dogs. Archives of Animal Nutrition, v. 56, n. 4, p. 309-318, 2002.
SWANSON, K. S.; GRIESHOP, C. M.; FLICKINGER, E. A.; BAUER, L. L.; CHOW, J.; WOLF, B. W.; FAHEY JR, G. C. Fructooligosaccharides and Lactobacillus acidophilus modify gut microbial populations, total tract nutrient digestibilities and
fecal protein catabolite concentrations in healthy adult dogs. The Journal of nutrition, v. 132, n. 12, p. 3721-3731, 2002.
THEODORO, S. D. S.; PUTAROV, T. C.; TIEMI, C.; VOLPE, L. M.; DE OLIVEIRA, A. F.; GLÓRIA, M. B. D. A.; CARCIOFI, A. C. Effects of the solubility of yeast cell wall preparations on their potential prebiotic properties in dogs. PLoS One, v. 14, n. 11, p. e0225659, 2019.
TWOMEY, L. N.; PLUSKE, J. R.; ROWE, J. B.; CHOCT, M.; BROWN, W.; PETHICK, D. W. The effects of added fructooligosaccharide (Raftilose® P95) and inulinase on faecal quality and digestibility in dogs. Animal feed science and technology, v. 108, n. 1-4, p. 83-93, 2003.
VIECHTBAUER, W.; CHEUNG, M.W.L. Outlier and influence diagnostics for meta‐ analysis. Research synthesis methods, v. 1, n. 2, p. 112-125, 2010.
ZENTEK, J.; MARQUART, B.; PIETRZAK, T. Intestinal effects of mannanoligosaccharides, transgalactooligosaccharides, lactose and lactulose in dogs. The Journal of nutrition, v. 132, n. 6, p. 1682S-1684S, 2002.
WILLARD, M. D.; SIMPSON, R. B.; COHEN, N. D.; CLANCY, J. S. Effects of dietary
fructooligosaccharide on selected bacterial populations in feces of dogs. American Journal of Veterinary Research, v. 61, n. 7, p. 820-825, 2000.