Orientador(a): Aulus Carciofi
Instituição: FCAV UNESP
Trabalho classificado na 9ª Edição (2023) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
Uma cachorra pug, fêmea, 7 anos, castrada, após o consumo acidental de “termogênico” à base de cafeína, triglicerídeos de cadeia média (TCM), chá verde e outros compostos apresentou intensa agitação e recorrentes episódios de vômito e diarreia. Na emergência, foi detectado aumento de pressão arterial, taquicardia e taquipneia. Foram administradas medicações para cessar o vômito e após 1 hora o animal apresentou angústia respiratória sendo necessária a sedação e intubação. Em oito dias, animal desenvolveu edema pancreático e 82 dias após a exposição acidental foi diagnosticado diabetes mellitus. A cafeína é um alcaloide de metilxantina, a intoxicação aguda afeta o sistema cardiovascular, pulmonar, neurológico, gastrointestinal. A indiscrição alimentar pode estar relacionada ao desenvolvimento de pancreatite aguda, causando comprometimento da função endócrina pancreática, o que resultou na diabetes melittus.
Palavras-chave: Cafeína, endocrinopatia, Intolerância alimentar, envenenamento
Introdução
Intolerância alimentar refere-se a qualquer resposta fisiológica anormal a um alimento ou aditivo. Aproximadamente 80% da população consome diariamente um produto contendo cafeína (Ogawa e Ueki, 2007), especialmente por seus efeitos estimulantes (Ludwig et al., 2014). Casos de acidentes com superexposição e mortalidade já foram relatados em cães (Fredholm, 2011).
A cafeína (1,3,7-trimetilxantina) é um alcaloide xantina de sabor amargo (Eteng, 1997). Este composto pode ser facilmente obtido e incorporado em alimentos atrativos para os animais, como produtos de grãos de café/cacau, produtos de chocolate, medicamentos, bebidas estimulantes, comprimidos e suplementos estimulantes (Tawde et al., 2012). Assim, podem ser ingeridos em dose tóxica de cafeína provocando a síndrome clínica (Craig, 2019). Não há relatos de uso intencional de cafeína com efeito letal, mas existem casos de acidentes com superexposição à cafeína e subsequente mortalidade em cães (Lee, 2020). Apesar de indiscrição alimentar e envenenamento serem relativamente comuns na casuística veterinária, a ingestão acidental com termogênico contendo cafeína em cães não foi encontrada na literatura, sendo o objeto do presente relato.
Intolerância alimentar em cães
Os mecanismos de intolerância à alimentos em cães e gatos incluem toxicidade alimentar, reações farmacológicas e metabólicas, dismotilidade, disbiose, efeitos físicos e sensibilidade dietética. As reações de intolerância alimentar são variáveis, geralmente dependentes da dose ingerida e podem ocorrer em qualquer idade. As reações farmacológicas são definidas como reações adversas a compostos alimentares biologicamente ativos, naturais e adicionados, como as metilxantinas presentes na cafeína (Allen et al. 1984). O produto ingerido continha 13 ingredientes, com objetivo de acelerar o metabolismo e auxiliar perda de peso. A estimativa de ingestão dos compostos presentes pelo animal é apresentada na tabela 1. Infelizmente alguns ativos não têm sua quantidade declarada pelo fabricante.

O principal ingrediente ingerido foi a cafeína (1,3,7-trimetilxantina) que é um composto orgânico com uma base purina chamada xantina (Wigderson, 1956). Após o consumo, a cafeína é quase completamente absorvida e metabolizada no fígado por enzimas de fase I (citocromo P450). A biodisponibilidade da cafeína é semelhante entre cães, ratos e camundongos (Arnaud, 2011). Em 1850, Lehmann relatou vários sinais clínicos dversos após administração oral de 2 a 10 g de cafeína. A síndrome foi denominada “cafeinismo”, caracterizada por inquietação, nervosismo, ansiedade, irritabilidade, agitação, tremor muscular, insônia, diurese, taquicardia, arritmia, respiração elevada e distúrbios gastrointestinais (Arnaud, 2005). Para cães, pode ser tóxica especialmente para o sistema nervoso central e cardiovascular. Polidipsia, vómitos, diarreia, e inquietação de 6 a 12 horas após a ingestão, seguidas por hiperatividade, poliúria, ataxia, tremores e convulsões. A morte pode ocorrer por arritmias cardíacas ou falha respiratória (Finlay e Guiton 2005).
Apresentação do caso
Cão, pug, castrada, de 11,5 kg de peso corporal (PC) foi encontrada junto ao pote de suplemento alimentar contendo dentre os ingredientes cafeína. O animal apresentava diarreia com escore de condição fecal (ECF) 1/5 (Carciofi, 2008), com odor de café, vômitos, excitação, dificuldade de deambulação, ofegação e polipdsia. Foi, então, levado em clínica de emergência. Ao exame físico foi detectado taquicardia (FC: 160 bpm), hipertermia (40 °C), taquipneia (FR: maior do que 200 MRPM), hipertensão (PAS: 140 mmHg), mucosas hipercoradas, hiperglicemia (147 mg/dL). Foram administradas as medicações (Tabela 2):
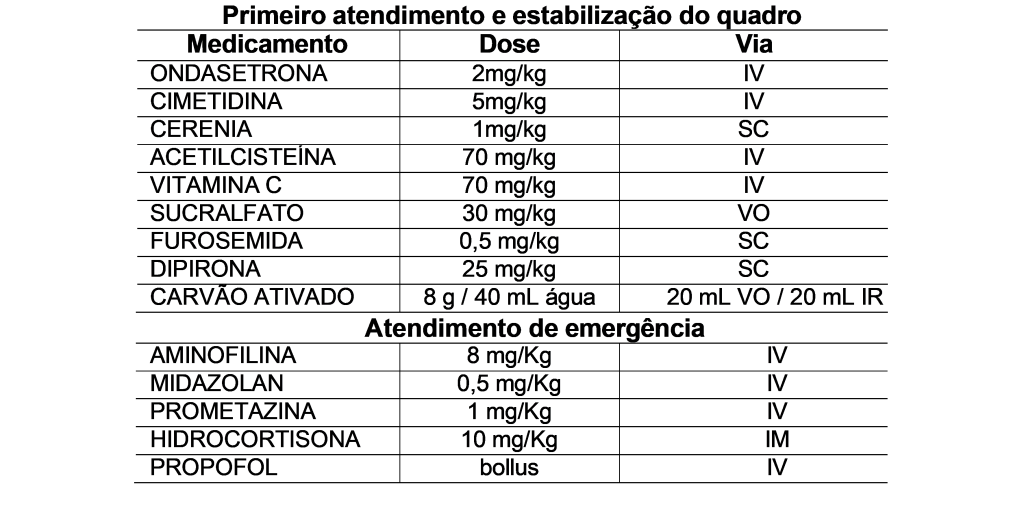
Após estabilização do quadro o paciente foi liberado. Ao entrar no carro, houve aumento do quadro de agitação e cianose. Assim, foi constatado angústia respiratória e prosseguiu-se com atendimento de emergência (Tabela 2). Ao tentar suporte de oxigênio com sonda intranasal houve lesão e epistaxe seguido de convulsão. A partir deste momento, foram necessários procedimentos de sedação, intubação orotraqueal e sondagem uretral. O animal apresentava taquicardia (180 bpm), hipertermia (39°C) e hipertensão. Foi mantido intubado durante três horas em fluidoterapia com infusão contínua de noradrenalina.
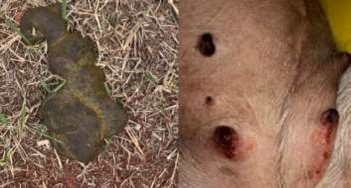
Após 48 horas ainda apresentava agitação, poliúria, polipdsia, fezes com ECF 2/5 ainda com odor de café e não conseguia se manter em pé; hiporexia, feridas cutâneas (Imagem 1) e tosse. Animal aceitou ração com palatabilizantes apenas 25% da sua necessidade energética de manutenção (NEM).
Após 48 horas da exposição, foi detectado tosse, PAS: 130, FC: 155 bpm. Eletrocardiograma havia aumento de duração de onda P e QRS sendo sugestivo de sobrecarga de átrio direito e ventrículo esquerdo. Foi prescrito fluidoterapia, protetores gástricos, hepatoprotetores, ácido ascórbico (70 mg/kg/IV BID) e carvão ativado (2 g/kg VO). A ultrassonografia detectou gastrite e hepatopatia grave. O animal apresentou perda de 7% de seu PC em três dias, nesse momento apresentava escore de condição corporal (ECC) 6/9 e escore de massa muscular (EMM) 2/3 (Laflamme, 1997).
Cinco dias após exposição, seguia com quadro de tosse e exame radiográfico sugestivo de bronquite e edema pulmonar. No oitavo dia, o animal estava estável, porém ainda apresentava diarreia ECF 2/5 e hiporexia, consumo inferior a 50% da sua NEM. Em ultrassonografia, as imagens sugeriram colite, alteração hepática por intoxicação e edema pancreático. Foi prescrito metronidazol (15 mg/kg VO BID), cerenia (0,1 ml/kg IV), tramal (4 mg/kg SC TID) e mirtazapina (0,6 mg/ Kg SID).
Quinze dias após a intoxicação, o paciente apresentava bom estado geral. Perdeu mais 400 gramas de PC, apresentava ECC 5/9 e EMM 1/3. Após um mês, apresentou sinais clínicos de cistite bacteriana e hiperglicemia (150 mg/dL), porém sem glicosúria. Animal perdeu mais 200 gramas de PC. O laudo de exame ultrassonográfico foi sugestivo de colite e pancreatopatia crônica.
Após 82 dias do acidente, o animal ainda apresentava hiperglicemia (320 mg/dL) e glicosúria, sendo então, concluído o diagnóstico de diabetes mellitus, decorrente da pancreatite aguda, e em consequência da intoxicação por termogênico. Foi prescrito o manejo com insulina de ação prolongada NPH (0,25 UI/kg BID) e manejo nutricional com alimento coadjuvante em duas refeições e mesma caloria. Desde o início o animal perdeu 1,5 kg de PC.
Discussão
Alimento humano é a segunda causa mais relatada de reações adversas em cães (APCC, 2023), estando a cafeína dentre os mais frequentes e um dos poucos que resultam em fatalidades (Lee, 2020). A meia-vida da cafeína em cães é em média 4,5 horas; os sinais clínicos podem surgir a qualquer momento após a ingestão e podem permanecer durante horas ou dias (Craig, 2019).
O consumo de grandes quantidades leva à saturação do metabolismo da cafeína (Martinzes-Lopes et al., 2014). A cafeína aumenta a renina plasmática, concentrações de catecolaminas e pressão arterial, estimula o miocárdio, com aumento da frequência cardíaca e nos rins promove diurese, justificando a poliúria e sobrecarga ventricular (Robertson et al., 1978).
A paciente apresentou quadro hiperglicêmico, que pode ser parcialmente justificado pela alta caloria ingerida pelo produto (550 kcal), sendo 93% da sua NEM. Além disso, há evidências que a cafeína sozinha promove efeitos adversos no metabolismo da glicose e reduz a sensibilidade à insulina (Lane, 2008, 2011). Estima-se que o animal tenha ingerido 58,3 mg de cafeína. Segundo Craft e Powell (2011) até 50 mg/kg: há sinais moderados, >50 mg/kg: sinais cardiotóxicos e entre 120–200mg/kg a Dose Letal 50 para cães.
Para os triglicerídeos de cadeia média não há relatos de toxicidade (Traul et al., 2000), esses apresentam diversas propriedades funcionais devido à forma como são absorvidos e metabolizados (Hand et al., 2000; Trevizan e Kessler, 2009). Outro fator foi a perda de peso aguda do paciente. Isso pode ser atribuído aos TCM e a cafeína, que aumenta a taxa metabólica, gasto energético e apresentam efeitos lipolíticos (Colleone, 2002; Fredholm, 2011).
O gengibre é considerado seguro e eficaz contra certas doenças (Kalpagam e Nirmala, 2003), e a pimenta negra (Piper nigrum) demonstrou efeitos hepatoprotetores, antioxidantes e prevenção de ganho de peso (Zodape; Gaikwad, 2019; Mballa, 2021). O extrato de chá verde (Camellia sinensis) é um ingrediente comum em alimentos secos para cães. As catequinas, ativo do chá verde, tem suposta ação anti-envelhecimento, antitumoral e antioxidantes (Plantz, 2017; Beynen, 2020). Estudos recentes realizados em cães em jejum revelaram efeitos letais limitadores de dose, incluindo necrose hepática, gastrointestinal e renal. Os mecanismos de toxicidade não são conhecidos (Wu e Boring, 2011). A dose de chá verde, piper nigrum, gengibre e TCM não era declarada e sua possível participação na intoxicação não pôde ser avaliada.
Após a intoxicação, o animal apresentou quadro de inflamação no pâncreas. A patogênese não é compreendida pois envolve múltiplas vias e processos inflamatórios (Mansfield, 2012; Walton, 2020). Independentemente da causa inicial, ocorre ativação desregulada e descontrolada de enzimas proteolíticas pancreáticas dentro das células acinares e sendo o tripsinogênio responsável pela morte celular (Dawra et al., 2011).
Para estimar a associação entre fatores dietéticos e pancreatite em cães (Lem et al., 2008) realizou um estudo retrospectivo com 198 casos de pancreatite em cães. Os relatos de ingestão de alimentos inadequados foram significativamente associados com pancreatite. Isso sugeriu que a exposição a um alimento incomum pode ser importante na patogênese da pancreatite.
Segundo (Santos e Alessi, 2016) a terapêutica para pancreatite aguda e hepatotoxicidade incluem hepatoprotetores, fluidoterapia, analgesia, gastroprotetores, antibióticos e nutricição. Apesar das alterações da pancreatite aguda, como edema, necrose e inflamação, serem reversíveis, pode ocorrer comprometimento das funções endócrina e exócrina e o desenvolvimento da Diabetes Melitus (Lack, 2003; Watson, 2012). Nesse caso é provável que a ingestão de alimento incomum levou ao quadro de pancreatite aguda, apesar de ser difícil determinar qual foi o ingrediente responsável dentre os compostos. Apesar da terapêutica, a enfermidade progrediu para diabetes melitus.
Conclusão
A ingestão de produto com cafeína resultou em intoxicação, perda de peso, edema pancreático e, consequente, diabetes mellitus. O conhecimento das doses tóxicas e mecanismos de ação dos compostos permite maior segurança de uso. Destaca-se que TCM, Piper nigrum e chá verde não tinham dose declarada, tornando difícil se estabelecer sua relação com o quadro clínico.
Referências bibliográficas
APCC, Animal Poison Control, 2023. Disponivel em: https://www.aspca.org/pet- care/animal-poison-control. Acesso em: 20/03/2023.
ALLEN, D. H., VAN NUNEN, S., LOBLAY, R., et al. Adverse reactions to foods.
The Medical Journal of Australia v.5, p.37-42, 1984.
ARNAUD, M.J. Pharmacokinetics and metabolism of natural methylxanthines in animal and man. Handb. Exp. Pharmacol. v.200, p33–91, 2011.
BEYNEN AC. Green-tea extract in petfood. Bonny Canteen, v.1, p.8-15, 2020.
CARCIOFI, A.C.; et al. Effects of six carbohydrate sources on dog diet digestibility and post-prandial glucose and insulin response. J. Anim. Physiol. Anim. Nutr, v.92, p.3266–336, 2008.
CRAFT, E.M., POWELL, L.L. Chocolate and Caffeine. In: OSWEILER G, HOVDA L, BRUTLAG A, LEE JA, EDS. Blackwell’s Five-Minute Veterinary Consult Clinical Companion: Small Animal Toxicology, p.421-428, 2011.
CRAIG, J. M. Food intolerance in dogs and cats. The Journal of small animal practice, v.2, p.77–85, 2019. https://doi.org/10.1111/jsap.12959
DAWRA, R., SAH, R.P., DUDEJA, V., RISHI, L., TALUKDAR, R., GARG, P.,
SALUJA, A.K. Intra-Acinar Trypsinogen Activation Mediates Early Stages of Pancreatic Injury but Not Inflammation in Mice With Acute Pancreatitis. Gastroenterology, v.141, p.2210–2217, 2011.
ETENG, M. et al. Recent advances in caffeine and theobromine toxicities: a review. Plant Foods Hum Nutr (Formerly Qualitas Plantarum) v.3, p.231–243, 1997.
FREDHOLM, B.B. Notes on the history of caffeine use. In Methylxanthines; Fredholm, B.B., Ed.; Springer: New York, p. 1–9, 2011.
FINLAY, F. e GUITON, S. Chocolate poisoning. British Medical Journal, v.331, p.633, 2005.
COLLEONE VV. Aplicações clínicas dos ácidos graxos de cadeia média. In: Curi R, Pompéia C, Miyasaka CK, Procopio J, editores. Entendendo a gordura: os ácidos graxos. São Paulo: Manole, p.439-54, 2002.
LACK, E. Pathology of the Pancreas, Gallbladder, Extrahepatic Biliary Tract, and Ampullary Region; Oxford University Press, p.2, 2003.
HAND, M.S., THATCHER, C.D., REMILLARD, R.L. et al. Small animal clinical nutrition. v.4, p.10, 2000.
KALPAGAM, P., NIRMALA, K.Ginger: Its role in xenobiotic metabolism, ICMR Bull., v.6, p.57–62, 2003.
LAFLAMME, D. P. Development and validation of a body condition score system for dogs: a clinical tool. Can Pract, v. 22, 1997.
LANE, J.D. Caffeine, glucose metabolism, and type 2 diabetes. J. Caffeine Res, v.1, p.23–28, 2011.
LANE, J.D.; FEINGLOS, M.N.; SURWIT, R.S. Caffeine increases ambulatory glucose and postprandial response in coffee drinkers with type 2 diabetes. Diabetes Care, v.31, p.221–222, 2008.
LEE, J.A. TOP 10 HUMAN FOOD TOXINS POISONOUS TO DOGS AND CATS.
Ontario Veterinary Medical Association, p. 542, 2020.
LEM, K. Y., FOSGATE, G. T., NORBY, B., STEINER, J. M. Associations between
dietary factors and pancreatitis in dogs. Journal of the American Veterinary Medical Association, v.9, p.1425–1431, 2008.https://doi.org/10.2460/javma.233.9.1425
LUDWIG, I.A., CLIORD, M.N., LEAN, M.E., ASHIHARA, H.; CROZIER, A. COEE:
Biochemistry and potential impaction health. Food Funct, v.5, p.1695–1717, 2014.
MANSFIELD C. Acute pancreatitis in dogs: advances in understanding, diagnostics, and treatment. Top Companion Anim Med, v.3, p.123-132, 2012.
MARTINEZ-LOPÉZ, S., SARRIÁ, B., BAEZA, G., MATEOS, R., BRAVO-
CLEMENTE, L. Pharmacokinetics of caffeine and its metabolites in plasma and urine after consuming a soluble green/roasted coffee blend by healthy subjects. Food Res. Int, v.64, p.125–133, 2014.
MBALLA, D., YADANG, F. S. A., TCHAMGOUE, A.D., MBA, J. R., TCHOKOUAHA, L.R.Y., M BIANG, E., TCHINDA, A., DZEUFIET, D. P., AGBOR,
- A. Cafeteria Diet-Induced Metabolic and Cardiovascular Changes in Rats: The Role of Piper nigrum Leaf Extract. Evidence-based complementary and alternative medicine, 2021. https://doi.org/10.1155/2021/5585650
OGAWA, H.; UEKI, N. Clinical importance of caffeine dependence and abuse.
Psychiatry Clin. Neurosci. V.61, p.263–268, 2007.
PLANTZ, B. Green tea extract use in dog and cat food. 2017. https://www.petfoodindustry.com/articles/7041-green-tea-extract-use-in-dog- and-cat-food. Acesso em: 19/03/2023
ROBERTSON, D.; FROLICH, J.C.; CARR, R.K.; WATSON, J.T.; HOLLIFIELD,
J.W.; SHAND, D.G.; OATES, J.A. Effects of caffeine on plasma renin activity, catecholamines and blood pressure. N. Engl. J. Med, v.298, p.1811–1886, 1978.
SANTOS, R.L.; ALESSI, A.C. Patologia Veterinária, 2nd ed.; Roca: Rio de Janeiro, Brazil, 2016.
TAWDE, S.N., PUSCHNER, B., ALBIN, T., STUMP, S., POPPENGA, R. H. Death
by caffeine: presumptive malicious poisoning of a dog by incorporation in ground meat. Journal of medical toxicology : official journal of the American College of Medical Toxicology, v.4, p.436–440 2012.
https://doi.org/10.1007/s13181-012-0254-y
TRAUL, K.A.; DRIEDGER, A.; INGLE, D.L. Rewiew of the toxicologic properties of medium-chain triglycerides. Food and Chemical Toxicology, v.38, p.79-98, 2000.
TREVIZAN, L., KESSLER, A.D.M. Lipídeos na nutrição de cães e gatos: metabolismo, fontes e uso em dietas práticas e terapêuticas. R Bras Zootec p.15–25, 2009. https://doi.org/10.1590/S1516-35982009001300002
WALTON, Acute Pancreatitis in Dogs Stuart. Todays veterinary practice, 2020.
WATSON, P. Chronic Pancreatitis in Dogs. Top. Companion Anim. Med, v.27, p.133–139, 2012.
WIGDERSON, F.J. Accidental caffeine poisoning in a dog. J Am Vet Med Assoc v.129, p.233, 1956.
WU, K. M., YAO, J., BORING, D. Green tea extract-induced lethal toxicity in fasted but not in nonfasted dogs. International journal of toxicology, v.1, p.19– 20, 2011. https://doi.org/10.1177/1091581810387445
ZODAPE, G. V. AND V. S. GAIKWAD. “Effect of Piper Nigrum (L.) on Hepatotoxicity Induced by Ethionamide and Para Amino Salicylic Acid in Sprague- Dawley Rats.” Biomedical & Pharmacology Journal, 2019.