Orientador(a): Mariana Cristina Hoeppner Rondelli
Instituição: Onconnectionvet
Trabalho classificado na 7ª Edição (2021) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A necessidade de ingestão de vitamina D para cães e gatos é conhecida, devido à incapacidade de sintetizá-la suficientemente por meio da ação cutânea dos raios solares ultravioletas B. Os níveis recomendados de vitamina D são indicados em guias consagrados. Este trabalho relata um caso de hipervitaminose D em um cão que apresentou hipercalcemia e importante elevação na concentração sérica de 25-hidroxicolicalciferol após suplementação de vitamina D3 por complemento alimentar. Um cão, sem raça definida, macho, castrado, de 4 anos de idade, peso 13,5 kg, escore de condição corporal 4/9 foi atendido por apresentar apatia, anorexia, êmese, poliúria e polidipsia por cinco dias. O cão recebia alimento caseiro formulado por um profissional e recebia 1g de complemento aviado em farmácia de manipulação sob prescrição. O paciente manifestou hipercalcemia (cálcio total 14,9 mg/dL; 9,0-11,3 mg/dL; e cálcio ionizado 1,75 mmol/L;1,2-1,45 mmol/L). As principais causas de hipercalcemia maligna foram investigadas (linfoma, carcinoma de saco anal, timoma). O peptídeo análogo do paratormônio e o paratormônio estavam normal (0,00 pmol/L; 0,0-1,0 pmol/L) e diminuído (0,00 pmol/L; 0,5-5,8 pmol/L), respectivamente, excluindo hiperparatireoidismo primário. Outras causas de hipercalcemia foram avaliadas (hipoadrenocorticismo, doenças granulomatosas e doença renal crônica) e a concentração sérica de 25-hidroxicolicalciferol estava 19,7 vezes acima do valor máximo esperado (7973,00 nmol/L; 109-403 nmol/L). Concluiu-se que era um caso de hipervitaminose D, possivelmente ocasionado pela ingestão de vitamina D que excedia entre 19 e 127 vezes os limites máximos diários ou o recomendado. Excluídas as principais causas de hipercalcemia, a hipervitaminose D deve ser considerada, embora seja incomum. Assim como no caso relatado, se a dieta for baseada em alimentação caseira suplementada, os detalhes da prescrição devem ser conferidos para garantir a segurança nutricional do paciente.
Introdução
A vitamina D é tema de estudos por uma centena de anos e sua importância na homeostase eletrolítica do cálcio e do fósforo é amplamente conhecida (McCOLLUME et al., 1922; MELLANBY, 1919; NORMAN, 2012).
As formas disponíveis de vitamina D são o ergocalciferol (vitamina D2), presente em produtos de origem vegetal, e o colicalciferol (vitamina D3), encontrado em produtos de origem animal (ZAFALON et al., 2020). Evidências demonstraram que cães são capazes de realizar conversão hepática do ergocalciferol em 25-hidroxi-vitamina D, enquanto que os gatos não apresentam esta habilidade (MORRIS, 2002a; PARKER; RUDINSKY; CHEW, 2017).
Compreende-se a necessidade de ingestão dietética de vitamina D para cães e gatos, uma vez que são incapazes de sintetizá-la suficientemente por meio da ação cutânea dos raios solares ultravioletas B (HOW; HAZEWINKEL; MOL, 1994). Para tal, os níveis recomendados de vitamina D para cães e gatos são indicados em guias consagrados (AAFCO, 2021; FEDIAF, 2020; NRC, 2006).
Embora as espécies carnívoras sejam consideradas mais resistentes à intoxicação por vitamina D (MORRIS, 2002b), cães e gatos podem desenvolver hipervitaminose D sob algumas circunstâncias, como: ingestão de rodenticidas à base de colicalciferol (GUNTHER et al., 1988); ingestão de cremes cuja composição seja um análogo da vitamina D (CAMPBELL, 1997); ingestão de plantas que contêm metabólitos da vitamina D; e a suplementação de vitamina D em cães e gatos com hipoparatireoidismo (FELDMAN; NELSON, 2004).
Outra causa de hipervitaminose D é a suplementação dietética excessiva, embora infrequente (MELLANBY et al., 2005). A hipercalcemia e a hiperfosfatemia são as alterações observadas inicialmente em animais intoxicados por vitamina D (GUNTHER et al., 1988). Neste sentido, faz-se necessário considerar os diagnósticos diferencias de hipercalcemia em cães que incluem: hiperparatireoidismo primário, doença renal crônica, hipoadrenocorticismo, doenças neoplásicas (linfoma, timoma, carcinoma de saco anal), doenças granulomatosas (criptococose, por exemplo) e menos comumente a hipervitaminose D (CARDOSO, 2015; FELDMAN; NELSON, 2004).
Destarte, este trabalho relata um cão que apresentou hipercalcemia e importante elevação na concentração sérica de 25-hidroxicolicalciferol após suplementação de vitamina D3 por meio de complemento alimentar.
Relato de caso
Um cão, sem raça definida, macho, castrado, de 4 anos de idade, peso 13,5 kg, escore de condição corporal 4/9, residente em apartamento e sem contactantes foi atendido por colega com queixa de apatia, anorexia, vômito, poliúria e polidipsia com evolução de cinco dias. O paciente não apresentava alterações dignas de nota no exame físico. A dieta era baseada no fornecimento de alimento caseiro formulado por um profissional, predominantemente composta de mandioquinha, arroz parboilizado, carne bovina magra cozida (tipo patinho), chuchu cozido e óleos de coco, linhaça e girassol, diariamente. Ademais, era acrescido 1g de complemento aviado em farmácia de manipulação sob prescrição.
O hemograma não apresentava alterações e nas dosagens bioquímicas foram constatados hipercalcemia (cálcio total 14,9 mg/dL; 9,0-11,3 mg/dL), discreto aumento na creatinina (1,8 mg/dL; 0,5-1,5 mg/dL) e valores normais para de fósforo, ureia, proteína total, albumina, globulina, fosfatase alcalina e alanina aminotransferase. Devido à suspeita de hipercalcemia maligna, o paciente foi encaminhado para avaliação oncológica.
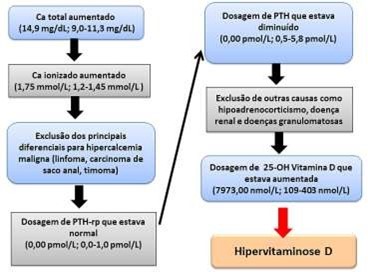
Frente a esta suspeita, foi realizada a dosagem do cálcio ionizado cujo resultado foi 1,75 mmol/L (1,2-1,45 mmol/L). Foi realizada a palpação dos linfonodos periféricos e dos sacos anais e os mesmos encontravam-se normais. Foi realizada radiografia torácica para pesquisa de massas em mediastino cranial para exclusão de linfomas mediastinais e de timoma, que se mostrou sem alterações. Dado o fato de alguns casos de carcinoma de saco anal serem microscópicos e não detectados no exame físico de rotina e da possibilidade de outros tumores estarem relacionados ao quadro de hipercalcemia maligna, foi solicitado exame ultrassonográfico e dosagem do peptídeo análogo ao paratormônio, o PTH-rp, de plasma obtido de amostra de sangue conservada com EDTA, enviado para análise em laboratório especializado em mensurações hormonais no exterior. A dosagem do PTH-rp foi 0,00 pmol/L (referência: 0,0 -1,0 pmol/L), portanto, estava dentro dos limites de referência.
Uma vez excluída a possibilidade de hipercalcemia maligna, foi iniciada a investigação de outras causas de hipercalcemia como hiperparatireoidismo primário, doença renal crônica, hipoadrenocorticismo, doenças granulomatosas e hipervitaminose D.
Para tal, foi realizada ultrassonografia cervical para avaliação das paratireoides, que estavam normais, assim como dosagem do paratormônio (PTH) sérico, com resultado 0,00 pmol/L (referência 0,5-5,8 pmol/L). Assim, foi possível eliminar a possibilidade de hiperparatireoidismo primário. Para exclusão de doenças granulomatosas, foi realizada radiografia torácica, ultrassonografia abdominal e não foram encontradas alterações relacionadas a possíveis lesões granulomatosas. A dosagem de sódio (143 mEq/L) e potássio (4,4 mEq/L) estavam normais assim como a relação Na/K foi de 32,5 (esperado >24), tornando o diagnóstico de hipoadrenocorticismo menos provável.
Após a exclusão dos principais diagnósticos diferenciais, a hipervitaminose D foi considerada e foi solicitada dosagem da fração 25-hidroxicolecalciferol da mesma amostra enviada ao referido laboratório para dosagem de PTH, e o resultado foi 7973,00 nmol/L (referência 109-403 nmol/L) (Figura 1).
Com base nesta suspeita, o suplemento utilizado foi avaliado e o enriquecimento mínimo de vitamina D3 declarado no rótulo era de 284,98 mg/kg de produto. Por dia, 1 g deste suplemento era adicionado ao alimento, portanto, é provável que o paciente recebia 284,98 µg ou 11.399,2 UI de vitamina D ao dia, possivelmente pelos últimos dois anos, segundo informações da anamnese.
Devido a magnitude da hipercalcemia e a presença de sinais clínicos evidentes, simultaneamente à investigação diagnóstica foi realizado tratamento de suporte com fluidoterapia intravenosa com solução salina a 0,9% e furosemida (1mg/kg – IV). Foi solicitada a substituição temporária do alimento caseiro por alimento comercial úmido para animal convalescente e realizada terapia de suporte com ondansetrona (0,5 mg/kg – IV – TID) e omeprazol (1 mg/kg – IV – SID). Após 48 horas da intervenção terapêutica, o cão já apresentava melhora clínica e o cálcio total sérico reduziu para 13,4 mg/dL. Cinco dias após a abordagem inicial, o animal apresentava resolução completa dos sinais clínicos, restabelecimento do cálcio sérico, e foi encaminhado para avaliação nutricional para adequação da dieta. Após um ano do diagnóstico inicial, a dosagem do cálcio ionizado foi 1,3 mmol/L.
Discussão
Os sinais clínicos apresentados pelo paciente, como anorexia, êmese, polidipsia e poliúria são comuns a diversas doenças, sendo imprescindível a investigação por exames laboratoriais e de imagem. Animais com hipercalcemia podem apresentar polidipsia e poliúria, uma vez que o excesso de cálcio reduz a ação do hormônio antidiurético (JARK et al., 2011; BERGMAN, 2012). A anorexia pode ser causada pela ação direta do cálcio no sistema nervoso central ou pela diminuição da excitabilidade das células musculares lisas do trato gastrointestinal (SCHENCK; CHEW, 2005), sinal este apresentado pelo paciente no ínicio do quadro clínico.
A primeira suspeita clínica do paciente foi hipercalcemia maligna, uma vez que esse é o principal diagnóstico diferencial de elevação de cálcio sérico em cães, sendo responsável por 58% dos casos de hipercalcemia (MESSINGER; WINDHAM; WARD, 2009). A hipercalcemia maligna é uma síndrome paraneoplásica associada principalmente com a produção de peptídeo análogo ao paratormônio (PTH-rp) pelas células neoplásicas, que aumenta a reabsorção do cálcio ósseo, levando à elevação nos níveis de cálcio sanguíneo (FINORA, 2003; MESSINGER; WINDHAM; WARD, 2009; BERGMAN, 2012). Em cães, os principais tumores relacionados a esse quadro são linfomas de células T, principalmente mediastinal, carcinomas de saco anal e timomas (BERGMAN, 2012; COADY; FLETHER; GOGGS, 2019; JARK et al., 2011; MESSINGER; WINDHAM; WARD, 2009). A triagem diagnóstica de palpação dos linfonodos periféricos (para investigação de linfoma multicêntrico) e palpação dos sacos anais (para carcinoma de saco anal) associada à radiografia de tórax sem alteração em mediastino cranial (investigação de timoma e linfoma mediastinal) tornou a hipercalcemia maligna pouco provável nesse paciente, porém devido ao fato da possibilidade de tumores microscópicos, principalmente no que se refere ao carcinoma de saco anal, foi realizada a dosagem de PTH-rp que estava normal e permitiu excluir a hipercalcemia maligna (JARK et al., 2011).
Outros diagnósticos diferenciais para hipercalcemia incluem doença renal crônica, hiperparatireoidismo primário, hipervitaminose D, lesões granulomatosas e hipoadrenocorticismo (CARDOSO, 2015; COADY; FLETHER; GOGGS, 2019; GALVÃO; CHEW; SCHENK, 2011). A ultrassonografia cervical e a dosagem de PTH permitiram a exclusão de hiperparatireoidismo primário e os demais exames complementares realizados auxiliaram a desconsiderar as demais possíveis causas de hipercalcemia.
Uma vez que as causas mais comuns de hipercalcemia foram percorridas, a suspeita passou a ser de hipervitaminose D. A dosagem de 25- hidroxicolicalciferol, que se mostrou 19,7 vezes acima do limite máximo esperado, juntamente com a verificação de hipercalcemia e concentração reduzida de PTH, foi essencial para determinar que tratava-se de um caso de hipervitaminose D.
O paciente do presente relato não tinha histórico de ingestão de rodenticidas contendo colicalciferol, de pomadas ou plantas que contêm análogos da vitamina D e também não houve ingestão acidental de vitamina D. Assim, mais atenção foi dada ao histórico nutricional.
No momento do atendimento inicial, o peso do cão era 13,5 kg e o escore de condição corporal era 4/9, de acordo com a escala proposta por Laflamme (1997). Portanto, o peso ideal estimado foi 14,8 kg e a necessidade de energia metabolizável diária definida foi 716,8 kcal (fornecimento de 95 kcal para cada kg de peso meta metabólico). Assim, dependendo do guia a ser utilizado como referência, a ingestão diária de vitamina D excedeu entre 19 e 127 vezes os limites máximos diários ou o recomendado (Quadro 1). De acordo com o histórico nutricional do paciente, este recebia alimento caseiro suplementado com complemento preparado para ele, de acordo com recomendações profissionais, por dois anos. Um ponto importante a ser destacado é que a unidade de vitamina D3 registrada no rótulo do produto aviado era miligrama, enquanto que as unidades usuais para a vitamina D3 são microgramas ou unidades internacionais, fato que pode ter contribuído para o equívoco no fornecimento da vitamina D3.
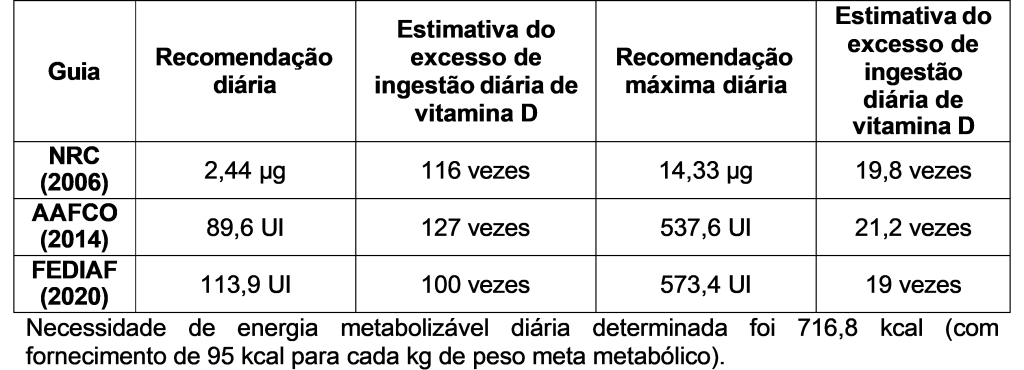
Os relatos de cães com hipervitaminose D em razão da ingestão dietética excessiva são escassos. Há descrições em cães que receberam alimentos comerciais com excessos inadequados de vitamina D3 na composição e que apresentaram hipercalcemia e sinais clínicos relacionados a esta alteração eletrolítica (MELLANBY et al., 2005). Com o aumento das indicações de dietas compostas por alimento caseiro nos últimos tempos, as informações mais disponíveis na literatura geralmente são de deficiências, a exemplo de um relato nacional de um cão que recebia dieta de eliminação caseira deficiente em 17 nutrientes, inclusive vitamina D (TEIXEIRA; SANTOS, 2016). Assim, o relato em tela corrobora a importância do rigor na elaboração das prescrições de dietas caseiras, principalmente com relação aos complementos, que merecem conferência periódica a fim de promover segurança ao paciente.
Uma limitação deste relato é que, por motivos de custos, as concentrações de PTH e de 25-hidroxicolicalciferol não foram repetidas após melhora clínica do paciente, embora as concentrações de cálcio total e ionizado tenham se restabelecido e o paciente esteja bem até o momento da escrita deste relato.
Conclusão
Uma vez excluídas as principais causas de hipercalcemia, a hipervitaminose D deve ser considerada, embora seja incomum. Assim como no caso relatado, se a dieta for baseada em alimentação caseira suplementada, os detalhes da prescrição devem ser conferidos a fim de garantir a segurança nutricional do paciente.
Referências bibliográficas
AAFCO. Association of American Feed Control Officials. AAFCO Dog and Cat Food Nutrient Profiles, 2014.
BERGMAN, P.J. Paraneoplastc hypercalcemia. Topics in Companion Animal Medicine, v. 24, n. 4, p. 156-158, 2012. doi: 10.1053/j.tcam.2012.09.003.
CAMPBELL, A. Calciptriol poisoning in dogs. Veterinary Record, v. 141, p. 27-28, 1997.
CARDOSO, M. J. L. Doenças da paratireoide: hipercalcemia e hipocalcemia. In: JERICÓ, M. M.; ANDRADE NETO, J. P.; KOGIKA, M. M. Tratado de Medicina
Interna de Cães e Gatos. 1 ed. 2 v. Rio de Janeiro: Roca, 2015, p. 1651-1665.
COADY, M.; FLETHER, D.J.; GOGGS, R. Severity of Ionized Hypercalcemia and Hypocalcemia Is Associated With Etiology in Dogs and Cats. Frontiers in Veterinary. Science., Aug, v. 6, 2019. doi: 10.3389/fvets.2019.00276.
FEDIAF. European Pet Food Industry Federation. Nutritional guidelines for complete and complementary pet food for cats and dogs. Belgium: European Pet Food Industry Federation Brussels, 2020.
FELDMAN, E. C.; NELSON, R. W. Hypercalcemia and primary hyperparathyroidism. In: Canine and Feline Endocrinology and Reproduction. 3. ed. Philadelphia: Saunders, 2004, p. 660- 715. ISBN-13: 978-0-
7216-9315-6.
FINORA, K. Common paraneoplastic syndromes. Clinical Tech Small Animal Practice. May, v.18, n. 2, p. 123-126, 2003. doi: 10.1053/svms.2003.36629.
GALVÃO, J. F. B; CHEW, D.; SCHENK, P. Hypercalcemia: diagnosis and treatment options in the dog and cat. Veterinary Focus. v. 21, p. 27-34, 2011.
GUNTHER, R.; FELICE, L. J.; NELSON, R. K.; FRANSON, A. M. Toxicity of a
vitamin D3 rodenticide to dogs. Journal of the American Veterinary Medical Association, Jul 15, v. 193, n. 2, p. 211-214, 1988.
HOW, K. L.; HAZEWINKEL, H. A. W.; MOL, J. A. Dietary vitamin D dependence of cat and dog due to inadequate cutaneous synthesis of vitamin D. General and Comparative Endocrinology, v. 96, n. 1, p. 12–18, 1994. https
://doi.org/10.1006/gcen.1994.1154.
JARK, P.J.; MONTEIRO, L.N.; GRANDI, F.; ROCHA, N.; LOURENÇO, M.L.G.;
MACHADO, L.H.A. Hipercalcemia maligna secundária a carcinoma do saco anal em um cão – A importância da identificação das síndromes paraneoplásicas.
Veterinária e Zootecnia. Dez, v. 18, n. 4, p. 558-562, 2011.
LAFLAMME, D. Development and validation of a body condition score system for dogs. Canine Practice, v. 22, p. 10-15, 1997. Disponível em:
<http://agris.fao.org/agris-search/search. do?recordID=US9742264>.
McCOLLUM, E. V.; SIMMONDS, N.; BECKER, J. E.; SHIPLEY, P. G. An
experimental demonstration of the existence of a vitamin which promotes calcium deposition. Journal of Biological Chemistry, v. 53, p. 293–298, 1922.
MELLANBY, E. An experimental investigation on rickets. Lancet, v. 116, p. 407- 412, 1919. doi: https://doi.org/10.1016/S0140-6736(01)25465-8.
MELLANBY, R. J.; MEE, A. P.; BERRY, J. L.; HERRTAGE, M. E. Hypercalcaemia
in two dogs caused by excessive dietary supplementation of vitamin D. Journal of Small Animal Practice, Jul, v. 46, n. 7, p. 334-348, 2005. doi: 10.1111/j.1748-
5827.2005.tb00329.x. PMID: 16035450.
MESSINGER, J.; WINDHAM, W.; WARD, C. Ionized Hypercalcemia in Dogs: A Retrospective Study of 109 Cases (1998–2003). Journal of Veterinary Internal Medicine. v. 23, p. 514-519, 2009. doi: doi.org/10.1111/j.1939-1676.2009.0288.x
MORRIS, J. G. Cats discriminate between cholecalciferol and ergocalciferol. Journal of Animal Physiology and Animal Nutrition, v. 86, n. 7– 8, p. 229–238, 2002a. https ://doi.org/10.1046/j.1439-0396.2002.00379.x.
MORRIS, J. G. Idiosyncratic nutrient requirements of cats appear to be diet- induced evolutionary adaptations. Nutrition Research Reviews, v. 15, n. 1, p. 153–168, 2002b. https ://doi.org/10.1079/NRR20 0238.
NORMAN A, W. The History of the Discovery of Vitamin D and Its Daughter Steroid Hormone. Annals of Nutrition and Metabolism, v. 61, p. 199-206, 2012. doi: 10.1159/000343104.
NRC. National Research Council. Nutrient requirements of dogs and cats. Washington, DC: National Academies Press, 2006.
PARKER, V. J.; RUDINSKY, A. J.; CHEW, D. J. Vitamin D metabolismo in canine and feline medicine. Journal of the American Veterinary Medical Association,
- 250, p. 1259–1269, 2017. https ://doi.org/10.2460/ javma.250.11.1259.
SCHENCK, P. A.; CHEW, D. J. Prediction of serum ionized calcium concentration by use of serum total calcium concentration in dogs. American Journal of Veterinary Research. v. 66, p. 1330-1336, 2005. doi: 10.2460/ajvr.2005.66.1330
TEIXEIRA, F. A.; SANTOS, A. L. S. Deficiências nutricionais graves em cão recebendo dieta de eliminação caseira. 2º Prêmio de Pesquisa Premier Pet, p. 3-11, 2016. Disponível em: https://www.premierpet.com.br/universitarios/premios- de-pesquisa/2o-premio/.
ZAFALON, R. V. A.; RISOLIA, L. W.; PEDRINELLI, V.; VENDRAMINI, T. H. A.; RODRIGUES, R. B. A.; AMARAL, A. R.; KOGIKA, M. M.; BRUNETTO, M. A.
Vitamin D metabolism in dogs and cats and its relation to diseases not associated with bone metabolism. Journal of Animal Physiology and Animal Nutrition.
Jan, v. 104, n. 1, p. 322-342, 2020. doi: 10.1111/jpn.13259.