Orientador(a): Bruno Benetti Giunta Torres
Instituição: Universidade Federal de Goiás (UFG)
Trabalho Classificado na 10ª Edição (2024) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A epilepsia é uma condição frequente em cães, sendo caracterizada por crises epilépticas recorrentes desencadeadas por diversos fatores. A epilepsia idiopática é uma forma crônica, mas sem causa específica identificável, mostrando-se desafiadora quanto ao tratamento e por reduzir a expectativa de vida do paciente. Junto a isso, percebe-se que a inflamação desempenha um papel de destaque na epileptogênese, influenciando na suscetibilidade às crises. Sabendo disso, a relação entre inflamação periférica e epilepsia tem sido cada vez mais estudada, evidenciando o impacto das citocinas pró-inflamatórias na permeabilidade da barreira hematoencefálica. Nesse contexto, o eixo intestino-encéfalo (EIE) desempenha um papel importante na comunicação bidirecional entre o sistema nervoso central (SNC) e o trato gastrointestinal, e por isso, disfunções do EIE correlacionadas a transtornos neurológicos tem sido alvo de novas pesquisas nas áreas médicas. Alguns desses estudos utilizam o cão como modelo de pesquisa, colaborando para a melhor compreensão dessa relação na medicina veterinária. Embora a fisiopatologia da epilepsia idiopática não seja totalmente esclarecida, o EIE demonstra modular vários mecanismos associados à epileptogênese. Dentro disso, a interconexão entre microbiota intestinal, inflamação, permeabilidade intestinal e SNC se mostrou influente na epileptogênese e na resposta ao tratamento da epilepsia. Terapias coadjuvantes, como dietas enriquecidas com triglicerídeos de cadeia média (TCM) e probióticos, demonstram grande potencial para melhorar a saúde intestinal e reduzir a inflamação em pacientes com epilepsia, colaborando com a menor probabilidade de recorrência de crises epilépticas. Logo, evidências cada vez mais significativas têm surgido, destacando a importância dos fatores ambientais na composição da microbiota, cujas disfunções, por sua vez, podem predispor a crises epilépticas. Contudo, diante do atual contexto científico, mais estudos e pesquisas são necessários para compreender o impacto dessas terapias na medicina veterinária e para desenvolver abordagens terapêuticas mais eficazes.
Introdução
A epilepsia é uma condição caracterizada por crises epilépticas recorrentes, desencadeando respostas inflamatórias no cérebro (Hall et al., 2020). Dentro disso, existe a epilepsia idiopática (EI), condição crônica que envolve crises recorrentes, podendo não contar com causas neurológicas específicas, fato esse que prejudica tanto o sucesso do tratamento quanto a qualidade de vida do paciente (Patterson et al., 2005; Masino et al., 2019). Junto a isso, diversas pesquisas demonstram que a saúde do intestino exerce uma influência considerável sobre o sistema nervoso central (SNC) (Masino et al., 2019). Isso é possível graças à comunicação bidirecional definida como eixo intestino-encéfalo (EIE) (Ambrosini et al., 2019). Em resumo, por meio desse, o SNC pode influenciar diversas funções do trato gastrointestinal (TGI), e, inversamente, as mensagens viscerais do TGI têm a capacidade de afetar a função cerebral. É interessante mencionar que a disfunção do EIE tem sido correlacionada com alguns transtornos psiquiátricos na medicina, como depressão e ansiedade, além de distúrbios neurodegenerativos, como o Parkinson e a doença de Alzheimer (Sampson et al., 2016). Nesse contexto, a medicina tem feito progressos significativos na compreensão da interação entre o EIE e a epilepsia, enquanto, na medicina veterinária, essa área de pesquisa ainda está em desenvolvimento (Ambrosini et al., 2019).
Junto a isso, o microbioma intestinal e seus metabólitos bacterianos, como os ácidos graxos de cadeia curta (AGCCs), mostraram-se ligados à manutenção da integridade da barreira intestinal, regulando a permeabilidade do epitélio intestinal e impedindo a infiltração de células bacterianas potencialmente patogênicas (Grider & Piland, 2007). Além disso, eles têm o potencial de afetar a barreira hematoencefálica (BHE), com implicações importantes na neuroinflamação e no desenvolvimento de crises epilépticas (Ambrosini et al., 2019). Por isso, merecem destaque os efeitos benéficos que uma dieta personalizada pode proporcionar à microbiota intestinal. Neste contexto, o objetivo deste trabalho é trazer os conhecimentos correntes da literatura sobre a relação entre inflamação intestinal, disbiose e saúde intestinal na fisiopatogenia da epilepsia idiopática canina.
Epilepsia idiopática (EI)
A EI é uma condição que resulta em crises epilépticas com manifestações motoras, autonômicas e/ou comportamentais (Hall et al., 2020). Na medicina veterinária, a EI é caracterizada por crises recorrentes sem outras anormalidades neurológicas associadas (Patterson et al., 2005). Ela é subdividida em três categorias: epilepsia idiopática genética, quando a mutação genética causal é confirmada; epilepsia idiopática com suspeita genética, baseada em alta prevalência em estudos de herdabilidade e histórico familiar; e epilepsia idiopática de causa desconhecida, cuja origem permanece incerta (Hall et al., 2020). Essa diversidade de subgrupos sugere diferentes susceptibilidades e respostas a fatores pouco estudados ou desconhecidos.
A maioria dos pacientes com EI, tanto humanos quanto caninos, responde bem aos fármacos anti-crises epilépticas (FACEs), mas cerca de 20% a 30% enfrentam epilepsia farmacorresistente, ou seja, não responsíveis a pelo menos dois FACEs, utilizados em mono ou politerapia (POTSCHKA et al., 2015). A fisiopatogenia do desenvolvimento de epilepsia farmacorresistente ainda é desconhecida. Entretanto, sabe-se que condições que aumentem as citocinas cerebrais podem elevar a suscetibilidade às crises, destacando a importância das respostas inflamatórias na gênese da epilepsia (Mazarati et al., 2017). Além disso, a ruptura da BHE resulta em inflamação cerebral e promove excitabilidade neuronal aumentada, contribuindo para o desenvolvimento de crises epilépticas (Oliveira et al., 2022).
Nesse contexto, um estudo de 2008 confirmou a relação entre inflamação intestinal e epilepsia em ratos, mostrando que fármacos que revertiam a inflamação também afetavam o limiar de excitabilidade. A inflamação intestinal pode diminuir a eficácia de FACEs e reduzir o limiar de excitabilidade, sugerindo que o estado fisiopatológico do intestino pode contribuir para a epilepsia em pacientes (Wang & Wang, 2016). Entretanto, os mecanismos subjacentes à forma pela qual a inflamação intestinal pode acentuar a predisposição às crises ainda não foram completamente esclarecidos.
Pesquisas indicaram que a indução de colite em ratos por meio do ácido 2,4,6- trinitrobenzeno sulfônico (TNBS) resultou em aumento nos níveis de citocinas, como IL-1βe TNF-αno hipocampo (Wang & Wang, 2016). Somado a isso, outro estudo comparou a prevalência de condições somáticas crônicas entre pessoas com epilepsia e com a população humana canadense geral, revelando que pacientes com epilepsia possuem maior prevalência de distúrbios gastrointestinais, como úlceras e inflamações estomacais/intestinais, quando comparados com a população em geral (Téllez-Zenteno et al., 2005).
Eixo intestino-encéfalo (EIE)
O EIE (figura 1) é uma rede de comunicação bidirecional entre o intestino e o encéfalo, que ocorre principalmente através do sistema nervoso entérico (SNE) e do sistema nervoso autônomo (SNA) (Grenham et al., 2011). Essa interação é crucial para a homeostase, envolvendo o SNC, o SNE, e a microbiota intestinal. Esses componentes formam uma rede reflexa complexa, com fibras aferentes projetando-se para áreas integrativas do SNC e projeções eferentes que afetam o trato gastrointestinal (Grenham et al., 2011). A microbiota intestinal pode influenciar os níveis de citocinas locais e induzir o “intestino permeável,” aumentando a permeabilidade gastrointestinal e afetando a função cerebral. Em resumo, essa comunicação bidirecional permite que o SNC influencie as funções do trato gastrointestinal e vice-versa (Asano et al., 2012).
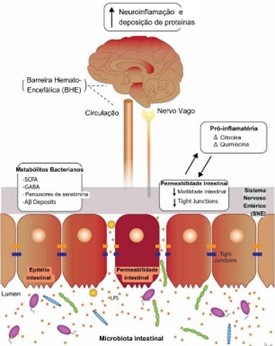
Por meio do EIE, o SNA influencia a produção de muco intestinal e ativa o sistema imunológico intestinal, afetando a permeabilidade do epitélio (Oliveira et al., 2022). O SNC recebe informações intestinais por substâncias liberadas por células neuroendócrinas, incluindo metabólitos bacterianos como AGCCs, que afetam o SNE e o cérebro (Tizard & Jones, 2018). A microbiota intestinal influencia a integridade das barreiras corporais, como a BHE (Oliveira et al., 2022). A compreensão dessas vias moleculares é crucial para investigar o papel do EIE na epileptogênese e nas interações entre microbiota intestinal, barreira intestinal, imunomodulação e SNC (Ambrosini et al., 2019).
Saúde intestinal
Um microbioma intestinal saudável requer equilíbrio entre papéis pró e anti- inflamatórios, e a capacidade de resposta às infecções. A disbiose está ligada a distúrbios gastrointestinais e inflamação, alterando a composição da microbiota e afetando metabólitos como AGCCs, aminoácidos e triptofano (Abdel-Haq et al., 2018). Episódios de diarreia canina estão associados à disbiose, afetando perfis de AGCCs e metabólitos (Ma et al., 2019). Isso leva à circulação de lipopolissacarídeos, patógenos e citocinas, ativando respostas imunes e promovendo inflamação local, incluindo neuroinflamação pela ativação da micróglia cerebral (Grenham et al., 2011). Aumento da permeabilidade da BHE pode facilitar a passagem de células imunes para o cérebro, contribuindo para inflamação. Citocinas intestinais pró-inflamatórias podem comunicar-se com o sistema imunológico cerebral, propagando a inflamação e aumentando a excitação neuronal (Dispenza, 2019). A degradação da BHE permite a infiltração de células brancas cerebrais, levando à neuroinflamação, potencialmente contribuindo para crises epilépticas. Esses achados sugerem uma ligação funcional entre disbiose e epilepsia pelo EIE (Oliveira et al., 2022)
Os ácidos graxos de cadeia curta (AGCCs)
Os AGCCs regulam a permeabilidade da barreira intestinal, prevenindo a infiltração bacteriana e mantendo a integridade do sistema. Eles também são essenciais para proteger o SNC, controlando a inflamação periférica e reduzindo a resposta inflamatória local (Oliveira et al., 2022).
Também influenciam a expressão de proteínas das junções estreitas nas células epiteliais e endoteliais, regendo a permeabilidade da barreira intestinal e prevenindo a invasão bacteriana. Além disso, o metabolismo microbiano, como o do Clostridium, e células do sistema nervoso, como micróglia, astrócitos e oligodendrócitos, contribuem para a manutenção da integridade da barreira BHE (Dispenza, 2019; García-Belenguer et al., 2023).
Influências da dieta no sucesso do tratamento
As dietas cetogênicas (DC) são uma opção terapêutica não farmacológica amplamente utilizada na medicina para pacientes com epilepsia refratária, bem como para aqueles que não são candidatos à cirurgia para ressecção da zona epileptogênica. Essas dietas são caracterizadas por serem ricas em gorduras, moderadas em proteínas e pobres em carboidratos, imitando o estado de cetose induzido pela fome (García-Belenguer et al., 2023). O sucesso das intervenções dietéticas na epilepsia inspirou estudos veterinários sobre o tema. Pesquisas preliminares sugerem que dietas enriquecidas com TCM podem afetar de forma distinta a microbiota intestinal, resultando em diferenças entre cães com epilepsia farmacorresistente e aqueles com epilepsia de início recente (Law et al., 2018). Ainda, as dietas demonstram propriedades anti-inflamatórias, mas as alterações na microbiota induzidas por elas variam entre os hospedeiros, influenciadas pela genética e pelos perfis basais da microbiota. Essas dietas também reduzem o ácido araquidônico (AA), um precursor de eicosanoides pró-inflamatórios, o que pode ter implicações na epilepsia, já que o ácido docosahexaenoico (DHA) e o AA regulam a inflamação. Em ratos, um novo mecanismo de ação proposto para o efeito antiepiléptico dos TCMs é o bloqueio dos receptores glutamatérgicos AMPA no cérebro, promovendo menor excitabilidade neural (García-Belenguer et al., 2023).
Nesse contexto, cabe a abordagem sobre o tratamento com fenobarbital (PB), um FACE amplamente utilizado no tratamento da EI canina, o qual demonstrou impacto na microbiota intestinal. Embora não tenha afetado significativamente a diversidade taxonômica dessa microbiota, o tratamento com PB resultou em diminuição na abundância de Clostridiales (Watanangura et al., 2022). Os níveis de AGCCs nas fezes, especialmente propionato e butirato, aumentaram notavelmente. Nesse contexto, cães que responderam bem ao PB tiveram níveis mais altos de butirato, diferente dos cães com epilepsia farmacorresistente. O butirato tem efeitos anti-inflamatórios e neuroprotetores, funcionando como fonte alternativa de energia para o cérebro, semelhante à dieta cetogênica em humanos. Também estimula a neurogênese, previne a apoptose neuronal, promove a remielinização, suprime a desmielinização e protege a barreira hematoencefálica (Masino et al., 2019).
Conclusão
Esta revisão demonstrou os possíveis impactos da saúde intestinal na EI canina. Há uma relação significativa e bidirecional entre o intestino e o encéfalo, onde mudanças intestinais podem perturbar a comunicação entre esses órgãos vitais. Notavelmente, a microbiota intestinal desempenha um papel crucial, influenciando a EI e sua resposta ao tratamento. Portanto, a conexão entre microbiota intestinal, inflamação e SNC é uma realidade que merece destaque, especialmente por suas prováveis implicações em condições neurológicas, como a epilepsia. Quadros de disbiose ou inflamação intestinal, que aumentam a permeabilidade intestinal, podem ativar células inflamatórias, que interagem com a BHE por meio do EIE, contribuindo para a neuroinflamação. Moléculas inflamatórias podem diminuir o limiar de excitabilidade e aumentar a predisposição a crises, evidenciando o papel crucial da inflamação na epileptogênese. Junto a isso, as alterações na microbiota induzidas pelas dietas enriquecidas com TCM, por exemplo, se mostraram benéficas, sendo, portanto, aliadas na estabilização do EIE, reduzindo a inflamação.
Portanto, esta revisão destaca como dietas e outras terapias coadjuvantes, visando a melhoria da saúde e da microbiota intestinal, podem oferecer uma alternativa promissora como tratamento complementar da EI, especialmente em pacientes farmacorresistentes. Vale ressaltar a importância do diagnóstico diferencial de disbioses, alergias alimentares ou quadros inflamatórios gastrointestinais para um tratamento mais preciso da epilepsia. É crucial refletir sobre melhorias no tratamento de suporte, levando em consideração a individualidade do paciente. Nesse contexto, suportes voltados para disbiose e hipersensibilidade alimentar parecem pertinentes, destacando a relevância do suporte à microbiota. Contudo, a medicina veterinária carece de mais pesquisas que visem entender o impacto de possíveis terapêuticas.
Referências
ABDEL-HAQ, R. et al. Microbiome–microglia connections via the gut–brain axis. Journal of Experimental Medicine, vol. 216, p. 41–59, 2018. DOI: 10.1084/jem.20180794.
AMBROSINI, Y. M. et al. The Gut-Brain Axis in Neurodegenerative Diseases and Relevance of the Canine Model: A Review. Frontiers in Aging Neuroscience, vol. 11, p. 130, 2019. DOI: 10.3389/fnagi.2019.00130.
ASANO, Y. et al. Critical role of gut microbiota in the production of biologically active, free catecholamines in the gut lumen of mice. American Journal of Physiology – Gastrointestinal and Liver Physiology, vol. 303, p. G1288–G1295, 2012. DOI: 10.1152/ajpgi.00341.2012.
DISPENZA, M. C. Classification of hypersensitivity reactions. Allergy & Asthma Proceedings, v. 40, n. 6, 2019.
GARCÍA-BELENGUER, S. et al. Effect of a Ketogenic Medium Chain Triglyceride- Enriched Diet on the Fecal Microbiota in Canine Idiopathic Epilepsy: A Pilot Study. Veterinary Sciences, vol. 10, n. 4, p. 245, 2023. DOI: 10.3390/vetsci10040245.
GRENHAM, S. et al. Brain-Gut-Microbiota Communication in Health and Disease. Frontiers in Physiology, vol. 2, p. 94, 2011. DOI: 10.3389/fphys.2011.00094.
HALL, R. et al. Estimation of the prevalence of idiopathic epilepsy and structural epilepsy in a general population of 900 dogs undergoing MRI for epileptic seizures. Veterinary Record, v. 187, p. e89-e89, 2020. DOI: 10.1136/vr.105647.
LAW, T. H. et al. Metabolic perturbations associated with the consumption of a ketogenic medium-chain TAG diet in dogs with epilepsy. British Journal of…
MA, Q. et al. Impact of microbiota on the central nervous system and neurological diseases: The gut-brain axis. Journal of Neuroinflammation, vol. 16, p. 53, 2019. DOI: 10.1186/s12974-019-1434-3.
MASINO, S. A. et al. Dietary intervention for canine epilepsy: Two case reports. Epilepsy Open, vol. 4, p. 1-7, 2019. DOI: 10.1002/epi4.12305.
MAZARATI, A. M. et al. Neurobehavioral comorbidities of epilepsy: The role of inflammation. Epilepsia, vol. 58, Suppl 3, p. 48-56, julho de 2017. DOI: 10.1111/epi.13786.
OLIVEIRA, F. et al. Role of Gut Microbiota through Gut–Brain Axis in Epileptogenesis: A Systematic Review of Human and Veterinary. Medicine Biologic, v. 11, p. 1290, 2022. Disponível em: <https://doi.org/10.3390/biology11091290>.
PATTERSON, E. E. et al. Results of a ketogenic diet trial in dogs with idiopathic epilepsy (abstract). Journal of Veterinary Internal Medicine, vol. 19, p. 421, 2005. DOI: não disponível.
POTSCHKA, H. et al. International veterinary epilepsy task force consensus proposal: Outcome of therapeutic interventions in canine and feline epilepsy. BMC Veterinary Research, v. 11, n. 177, 2015. https://doi.org/10.1186/s12917-015-0465-y.
SAMPSON, T. R. et al. Gut Microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease.Cell, v. 167, p. 1469.e12–1480.e12, 2016. doi: 10.1016/j.cell.2016.11.018.
TÉLLEZ-ZENTENO, J. F.; MATIJEVIC, S.; WIEBE, S. Somatic comorbidity of epilepsy in the general population in Canada. Epilepsia, v. 46, n. 12, p. 1955–1962, 2005. Disponível em: https://doi.org/10.1111/j.1528-1167.2005.00344.x.
TIZARD, I. R.; JONES, S. W. The microbiota regulates immunity and immunologic diseases in dogs and cats. Veterinary Clinics of North America: Small Animal Practice, v. 48, p. 307–22, 2018. doi: 10.1016/j.cvsm.2017.10.008.
WANG, H. X.; WANG, Y. P. Gut microbiota-brain axis. Chinese Medical Journal, v. 129, n. 19, p. 2373-2380, 2016.
WATANANGURA, A. et al. The effect of phenobarbital treatment on behavioral comorbidities and on the composition and function of the fecal microbiome in dogs with idiopathic epilepsy. Frontiers in Veterinary Science, vol. 9, artigo 933905, 2022. DOI: 10.3389/fvets.2022.933905