

Orientador(a): Fábio Alves Teixeira
Instituição: Profissional autônomo
1° Colocado na 10ª Edição (2024) do Prêmio de Pesquisa PremieRpet®.
Índice
As lesões na cavidade oral de gatos podem ser classificadas como estomatite ou gengivoestomatite felina, que são condições inflamatórias crônicas da mucosa oral que afeta cerca de 0,7% dos gatos atendidos em clínicas veterinárias. O diagnóstico é feito por exame clínico, e complementares, especificamente histopatológico. As causas são multifatoriais e incluem agentes infecciosos, fatores genéticos e ambientais. A terapêutica consiste em abordagens farmacológicas e até cirúrgicas, visando controlar a inflamação e melhorar a qualidade de vida do paciente. Na literatura há discussões do possível envolvimento de reação adversa ao alimento como uma possível causa de lesões na cavidade oral. Para suspeita de reação adversa ao alimento, o diagnóstico é baseado em remissão do quadro após dieta de eliminação, seguido por novas manifestações com a exposição do animal aos possíveis antígenos e nova remissão na repetição do período de alimentação hipoalergênica. Nesse caso, a mudança dietética seria o tratamento. Entretanto, não há pesquisas focadas nessa hipótese patogênica nem relato de casos contundentes que comprovem essa possibilidade. Este relato de caso descreve o tratamento de uma paciente com gengivoestomatite felina que apresentava lesões orais refratárias ao tratamento convencional com prednisolona e ciclosporina, mesmo após tratamento periodontal e exodontia parcial. Então, optou-se por realizar dieta de eliminação. Animal recebia alimentação seca extrusada de manutenção e mudou-se para, exclusivamente, alimento seco extrusado coadjuvante hipoalergênico à base de proteína hidrolisada, sem modificação na terapia medicamentosa, que fora mantida sob mesma dose e frequência. Após 30 dias da mudança alimentar, houve remissão completa das lesões. Animal fora então submetido a reexposição ao alimento anterior, com surgimento de novas lesões após 7 dias. Com retorno para alimento hipoalergênico, houve nova remissão das lesões. O presente relato sugere que a sensibilidade alimentar pode desempenhar papel importante no controle da gengivoestomatite felina, visto que os períodos de dieta com alimento hipoalergênico coincidiram com remissão do quadro, mesmo sem mudança medicamentosa; e reforça a importância de investigação sobre reação adversa ao alimento manifestarem-se como lesões na cavidade oral dos gatos
Introdução
A estomatite é um processo inflamatório complexo, crônico e destrutivo que afeta o epitélio e a lâmina própria, com frequente extensão para os tecidos submucosos. Já a gengivoestomatite felina é uma condição que afeta a cavidade oral de gatos, caracterizada por inflamação grave na mucosa. As lesões são ulcerativas e proliferativas e frequentemente localizadas nas regiões próximas aos dentes pré-molares e molares, mas podem se estender para o palato, língua e faringe, e em alguns casos observa-se lesão de reabsorção dentária. Estima-se que essa inflamação da mucosa oral afete 0,7% dos gatos que frequentem atendimentos veterinário (DIEHL et al., 1993; GIOSO, 2003; NIZA et al., 2004; LYON 2005; SOLTERO‐RIVERA; REITER, 2020)
A etiopatogenia ainda não é totalmente clara, mas sabe-se que é multifatorial, com alteração na resposta imune, atrelada à produção de linfócitos T e imunoglobulinas, que pode ter relação com agentes infecciosos como vírus (da leucemia felina, imunodeficiência felina, calicivírus, herpesvírus e da panleucopenia) e bactérias comensais da cavidade oral (WILLIAMS, 1992; HEALEY, 2007; ROBSON e CRYSTAL, 2011). Uma das principais causas de cronicidade da doença é a exposição da mucosa oral aos agentes presentes na placa bacteriana dentária, elevando gravidade das lesões (WILLIAMS, 1992; LYON, 2005). Outros possíveis desencadeantes, estão relacionados à sensibilidade alimentar, fatores genéticos e ambientais (ROBSON e CRYSTAL, 2011).
As manifestações clínicas variam com o grau das lesões na mucosa oral, mas podem incluir: halitose, ptialismo, hiporexia, anorexia, disfagia, mudança de comportamento pela dor, como agressividade e isolamento, e, em consequência disso, o paciente apresenta perda de peso progressiva, desidratação e inicia processo de proteólise e lipólise (NIZA et al., 2004; LYON, 2005, LOMMER, 2013). No exame físico oral pode-se observar o processo inflamatório na mucosa.
Exames complementares são necessários para descartar afecções sistêmicas e exclusão de diferenciais que causem ulcerações orais (DIEHL et al., 1993; GIOSO, 2003). Em histopatológico evidencia-se hiperplasia do epitélio oral com ulcerações profundas, e infiltrado de células inflamatórias (HENNET, 1997).
O controle da inflamação é mais comumente obtido quando se associa tratamento clínico e cirúrgico, com objetivo de melhora na qualidade de vida e não a cura da doença (HENNET, 1997; CRYSTAL, 2004; NIZA et al., 2004; HOFMANN-APPOLLO et al., 2010). O tratamento cirúrgico consiste na profilaxia dentária e na exodontia. Na parcial, ocorre a extração dos dentes molares e pré-molares, enquanto na exodontia total, todos os dentes são removidos. Essa intervenção visa minimizar o contato da mucosa oral com a placa bacteriana, e a estimulação imune (HOFMANN-APPOLLO et al., 2010). Já o tratamento clínico objetiva controlar a dor, reduzir a inflamação e infecção e promover a imunossupressão (NIZA et al., 2004).
Independente da causa, o manejo nutricional nesses casos é fundamental pois com comprometimento oral, há grande chance de o paciente não se alimentar adequadamente. Além disso, a hipersensibilidade alimentar é citada (DIEHL et al., 1993) como potencial desencadeador de gengivoestomatite. No entanto, não foi encontrado na literatura evidências de que a mudança da alimentação auxilie no controle da inflamação da mucosa oral. O objetivo deste estudo é relatar um caso de controle da inflamação oral em um felino com uso de alimento hipoalergênico extrusado a base de proteína hidrolisada.
Relato de caso
Foi atendido paciente felino, domiciliado, fêmea, 2 anos de idade, castrado, FIV e FeLV negativos, com queixa de hematúria, poliúria e disúria. Apesar disso, apresentava-se em normorexia, normodipsia e ativo. Alimentação era a base de alimento seco extrusado de manutenção tendo como principais ingredientes: carne de frango, farinha de vísceras de aves, ovo desidratado, farinha de peixe, proteína isolada de suíno, amido de batata e amido de mandioca. Ao exame físico, observou- se escore de condição corporal 6/9 (LAFLAMME, 1997), escore de massa magra 3/3 (MICHEL et al., 2011), pelagem saudável e parâmetros vitais no intervalo de referência. No entanto, ao examinar a cavidade oral, foram observadas lesões ulceradas em região da mucosa bucal caudal e gengivite nos dentes pré-molares superiores (Figura 1).
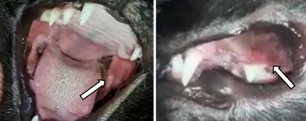
Outras afecções foram descartadas uma vez que os parâmetros de hemograma, ureia, creatina, ALT, AST, proteínas totais, albumina, urinálise, cultura e antibiograma de urina, e ultrassonografia abdominal estavam sem alterações. Nesse primeiro atendimento (dia 1) foi prescrito prednisolona (por via oral (VO) 1 mg/kg/SID) e amitriptilina (2,5 mg/SID, VO). Após o 8º dia de tratamento clínico o paciente apresentou melhora completa das alterações urinárias, porém as lesões na cavidade oral mantinham-se iguais. A partir do 10º dia, a dose de prednisolona foi gradualmente reduzida até a suspensão completa da medicação. Foi acrescentada ciclosporina (7 mg/kg/SID VO) e indicado o tratamento cirúrgico para profilaxia oral e exodontia dos dentes com gengivite e reabsorção óssea (Figura 2).
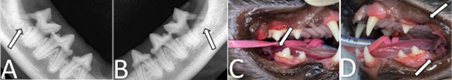
Mesmo após 30 dias do procedimento, em que foram removidos três molares, e sob medicação, a paciente continuava com as mesmas lesões orais. Optou-se por substituir dieta por alimento seco extrusado hipoalergênico, a base de proteína hidrolisada de soja e quirera de arroz, prescrita sob necessidade energética de manutenção [NEM = 75 x PC0,67, em que PC = peso corporal (FEDIAF, 2021)]. Após 30 dias, paciente estava com completa remissão das lesões (Figura 3A). Nesse momento, foi realizada reexposição alimentar, sem modificação na terapia com ciclosporina, utilizando o alimento seco extrusado que animal recebia anteriormente. Após sete dias, a paciente voltou a apresentar inflamação na mucosa oral (Figura 3), quando se retornou para alimento hipoalergênico e paciente apresentou nova melhora completa das lesões em poucos dias.
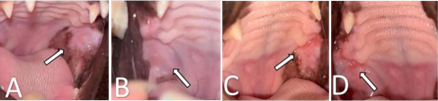
Após a estabilização do paciente, procedeu-se à redução da dose da ciclosporina, porém não se obteve boa resposta, sendo necessário retornar à dose inicial. Após 6 meses, a paciente permanece estável com a administração diária de ciclosporina e alimento seco hipoalergênico, sem acesso a nenhum outro alimento. Além disso, foi recomendado ao responsável pelo animal rigoroso controle na quantidade de alimento, com intuito de evitar que a paciente apresente ganho de peso e passa a situação de sobrepeso importante, piorando o quadro da felina.
Discussão
Inicialmente paciente foi medicada com prednisolona a fim de reduzir o processo inflamatório, pois ação é efetiva em 70 a 80% dos casos (NIZA et al., 2004), com possível ação também nas manifestações do trato urinário inferior, que poderiam ser justificados pelo estresse e dor, que fora manejado com a amitriptilina, que é um antidepressivo tricíclico com propriedades anti- inflamatórias, analgésicas, simpatolíticas, anti-histamínicas e anticolinérgicas (WESTROPP, 2016).
No 8º dia do tratamento, apesar da remissão das manifestações urinárias, permaneciam as lesões ulcerativas bucais. Foi realizado tratamento periodontal específico pois, LYON (2005) estima sucesso em 80% dos casos, devido à diminuição da estimulação antigênica. Associado, procedeu-se administração de ciclosporina, classificada com imunossupressor que inibe a ativação dos linfócitos T ao reduzir as citocinas pró-inflamatórias (LOMMER, 2013).
Após 30 dias do uso do medicamento, era esperada melhora, principalmente porque o tratamento cirúrgico já havia sido realizado (HOFMANN-APPOLLO et al., 2010). A ciclosporina tem tempo médio de 2 a 6 semanas até se observar início da melhora dos quadros de lesões. Entretanto, paciente não apresentara melhora das lesões, mesmo já tendo sido realizado tratamento cirúrgico.
Alguns autores (DIEHL et al., 1993; ROBSON e CRYSTAL, 2011; JOHNSTON, 2012), sugerem que o manejo nutricional similar ao abordado nos quadros de alergia alimentar seja relevante nesses casos, porém não foi encontrado na literatura estudos ou mesmo relatos de caso que demonstrem claramente essa relação entre lesões orais e hipersensibilidade alimentar. De acordo com CARLOTTI (1990), as principais manifestações clínicas de sensibilidade alimentar em felinos são cutâneas e gastrointestinais (MUELLER; OLIVRY, 2018), com relatos de alterações oftálmicas, respiratórias e de comportamento (WHITE; SEQUOIA, 1989; HOBI et al., 2011; MAZZERANGHI et al., 2017).
O diagnóstico e tratamento de reações adversas ao alimento é baseado no uso de dieta de eliminação seguido por exposição provocativa (MUELLER; OLIVRY, 2017), conforme realizado na paciente relatada. O período recomendado para eliminação é de até oito semanas (OLIVRY; MUELLER; PRÉLAUD, 2015), seguido por provocativo nos felinos por uma a duas semanas (OLIVRY; MUELLER, 2020). Como houve a mudança alimentar e manutenção da paciente exclusivamente com alimento hipoalergênico, ocorrendo a primeira melhora completa das lesões ulcerativas na mucosa oral, sem mudança em protocolo medicamentoso ou ambiental, pode-se aventar a possibilidade de que a paciente apresentava reação adversa ao alimento, manifestada por lesões na cavidade oral. A hipótese levantada é que a estimulação antigênica crônica causada por algum componente do alimento, era cofator para a perpetuação do processo inflamatório. O alimento com proteína hidrolisada pode ter auxiliado nesse processo, pois a hidrólise reduz o peso molecular da proteína, diminuindo a possibilidade do reconhecimento dos epítopos pelo sistema imunológico, que potencialmente desencadearia a reação adversa ao alimento (OLIVRY, 2010).
Pode ser questionado o fato de a ciclosporina ter demorado a alcançar sua ação máxima e isso ter ocorrido no momento de dieta de eliminação. Entretanto, a exposição da paciente novamente ao alimento de manutenção e a recorrência das lesões na mucosa oral, seguido pela nova remissão com retorno ao alimento hipoalergênico aumentam as evidências de que a alimentação pode ser um fator importante no controle do processo inflamatório dessa paciente.
No caso relatado, optou-se por manter paciente sob alimentação hipoalergênica e ciclosporina, pois a tentativa inicial de suspender os tratamentos, individualmente, foi má- sucedida. Porém não se sabe como seria a nova tentativa de suspensão da medicação ou nova troca da alimentação, após longo prazo.
Na ‘Proposta de Guia para Manejo da Síndrome da Gengivoestomatite Crônica Felina’ (CAMY et al., 2010), apesar de os autores comentarem que pode ser interessante realizar mudanças alimentares nesses casos, não há estudos robustos que embasem o uso de alimentos hipoalergênicos. Assim, estudos com melhor grau de evidência cientifica, que avaliem prospectivamente gatos com gengivoestomatite submetidos à dieta de eliminação e exposição provocativa, podem reforçar o achado desse relato de que reações adversas ao alimento podem estar associadas às lesões na cavidade oral, e que o uso de alimento hipoalergênico poderia ser coadjuvante ao tratamento desses casos.
Entretanto, na prática clínica, a avaliação alimentar dos pacientes felinos com gengivoestomatite pode ser desafiadora, pois muitas vezes esses animais apresentam hiporexia (NIZA et al., 2004; LYON, 2005, LOMMER, 2013) e talvez não aceitem a mudança alimentar, sem a qual talvez o paciente continue exposto aos possíveis antígenos alimentares. Isso talvez justifique o porquê de muitos casos de lesões na cavidade oral de felinos serem refratários ao tratamento anti- inflamatório e imunossupressor, como provavelmente seria o caso dessa paciente que não respondeu a corticoterapia nem ao primeiro ciclo mensal de imunossupressor mais recomendado, a ciclosporina (LOMMER, 2013), mesmo após tratamento periodontal.
Conclusão
O caso relatado evidencia a possibilidade de reação adversa ao alimento como cofator em quadro de lesões na cavidade oral de felino, diagnosticada por meio de dieta de eliminação e exposição provocativa, além do benefício do uso de alimento hipoalergênico a base de proteína hidrolisada como coadjuvante no tratamento.
Referências bibliográficas
CAMY, G.; FAHRENKRUG, P.; GRACIS, M.; HENNET, P.; UK, N. J.; MIHALJEVIC, S.; SCHREYER, J. Proposed guidelines on the management of Feline Chronic Gingivostomatitis (FCGS) syndrome: a consensus statement Consultation Version September 2010. J Feline Med Surg, p. 20–244, 2010. |
CARLOTTI, D. N.; REMY, I.; PROST, C. Food Allergy In Dogs And Cats. A Review and Report of 43 Cases. Vet Dermatol. 1990 Mar;1(2):55-62. |
CRYSTAL, M. A. Feline oral inflammation and periodontal disease: Recognition, diagnosis, and treatment. Veterinary Clinics of North America: Small Animal Practice, Philadelphia, v. 34, n. 5, p. 1067-1084, 2004. |
DIEHL, J. J. E.; NOVIS, M. F.; GIOSO, M. A. Gengivite e Estomatite. In: NOVIS, M. F.; GIOSO, M. A. (org.). Tratado de Medicina Interna de Cães e Gatos. 1. ed. São Paulo: Roca, 1993. p. 759-761. |
GIOSO, M. A. Gengivoestomatite crônica felina. Clínica Veterinária, São Paulo, v. 21, n. 124, p. 56-62, 2003. |
HEALEY, K. A. Feline Stomatitis: Current concepts in diagnosis and therapy. Journal of Veterinary Dentistry, Chicago, v. 24, n. 3, p. 184-191, 2007. |
HENNET, P. Canine periodontal disease: etiology, pathogenesis, and treatment. Journal of Veterinary Dentistry, Chicago, v. 14, n. 3, p. 5-8, 1997. |
HOBI, S.; LINEK, M.; MARIGNAC, G.; OLIVRY, T.; BECO, L.; NETT, C.; FONTAINE, J.; ROOSJE, P.; BERGVALL, K.; BELOVA, S.; KOEBRICH, S.; PIN, D.; KOVALIK, M.; MEURY, S.; WILHELM, S.; FAVROT, C. Clinical characteristics and causes of pruritus in cats: a multicentre study on feline hypersensitivity‐ associated dermatoses. Veterinary Dermatology, v. 22, n. 5, p. 406–413, 15 out. 2011. |
HOFMANN-APPOLLO, J.; MOORE, G. E.; ALLMAN, D. A. Periodontal Disease. In: BOJORQUEZ, A. D. Manual of Small Animal Dentistry. 1. ed. Ames: Wiley- Blackwell, 2010. p. 168-189. |
JOHNSTON, N. An updated approach to chronic feline gingivitis stomatitis syndrome. Veterinary Practice, v. 44, p. 34–38, 2012. |
LESPONNE, I.; PARA, J.; PLANCHON, S.; SERCHI, T.; MONTANO, M. Análises de DNA e proteínas para confirmar a ausência de contaminação cruzada e apoiar a confiabilidade clínica de dietas extensivamente hidrolisadas para animais de estimação com reações adversas a alimentos. Ciências Veterinárias, 5(3), 63–, 2018. |
LOMMER, M. J. Efficacy of cyclosporine for chronic, refractory stomatitis in cats: A randomized, placebo-controlled, double-blinded clinical study. Journal of Veterinary Dentistry, 30(1), 8-17, 2013. |
LOMMER, M. J. Oral inflammation in small animals. Veterinary Clinics of North America: Small Animal Practice, 43(3), 555-571, 2013. |
LYON, K. Feline stomatitis: An update on current understanding and treatment. Journal of Feline Medicine and Surgery, London, v. 7, n. 1, p. 3-14, 2005. |
MAZZERANGHI, F.; ZANOTTI, C.; DI CERBO, A.; VERSTEGEN, J. P.; COCCO, R.; GUIDETTI, G.; CANELLO, S. Clinical efficacy of nutraceutical diet for cats with clinical signs of cutaneus adverse food reaction (CAFR). Polish Journal of Veterinary Sciences, v. 20, n. 2, p. 269–276, 1 mar. 2017. |
MUELLER, R. S.; OLIVRY, T. Critically appraised topic on adverse food reactions of companion animals (4): can we diagnose adverse food reactions in dogs and cats with in vivo or in vitro tests? BMC Veterinary Research, v. 13, n. 1, p. 275, 30 dez. 2017. |
MUELLER, R. S.; OLIVRY, T. Critically appraised topic on adverse food reactions of companion animals (6): prevalence of noncutaneous manifestations of adverse food reactions in dogs and cats. BMC Veterinary Research, v. 14, n. 1, p. 341, 12 dez. 2018. |
NIZA, M. M. R.; FARIA, M. L.; ABRANTES, A. M. P. Doença periodontal em gatos – diagnóstico e tratamento. Clínica Veterinária, Lisboa, v. 104, p. 21-28, 2004. |
OLIVRY, T.; BIZIKOVA, P. A systematic review of the evidence of reduced allergenicity and clinical benefit of food hydrolysates in dogs with cutaneous adverse food reactions. Veterinary Dermatology, 21(1), 32–41, 2010 |
OLIVRY, T.; MUELLER, R. S. Critically appraised topic on adverse food reactions of companion animals (9): time to flare of cutaneous signs after a dietary challenge in dogs and cats with food allergies. BMC Veterinary Research, v. 16, n. 1, p. 158, 24 dez. 2020. |
OLIVRY, T.; MUELLER, R. S.; PRÉLAUD, P. Critically appraised topic on adverse food reactions of companion animals (1): duration of elimination diets. BMC Veterinary Research, v. 11, n. 1, p. 225, 28 dez. 2015. |
ROBSON, D.; CRYSTAL, M. A. Feline periodontal disease: Clinical and histopathologic features of chronic stomatitis. Veterinary Clinics of North America: Small Animal Practice, Philadelphia, v. 41, n. 6, p. 1031-1049, 2011. |
SOLTERO‐RIVERA, M. M.; REITER, A. M. Diseases of the Oral Cavity and Salivary Glands. Em: Clinical Small Animal Internal Medicine. [s.l.] Wiley, 2020. p. 533– 546. |
WESTROPP, J. L.; BUFFINGTON, C. A. Feline Idiopathic Cystitis. In: LITTLE, S. E. (org.). August’s Consultations in Feline Internal Medicine. 7. ed. St. Louis: Elsevier, 2016. p. 518-525. |
WHITE, S. D.; SEQUOIA, D. Food hypersensitivity in cats: 14 cases (1982-1987). Journal of the American Veterinary Medical Association, v. 194, n. 5, p. 692– 5, 1 mar. 1989. |
WILLIAMS, D. L. Oral diseases of dogs and cats. In: HARVEY, R. G. Veterinary Dentistry: A Team Approach. 1. ed. St. Louis: Saunders, 1992. p. 158-199. |





