

Orientador(a): Marcio Antonio Brunetto
Instituição: FMVZ USP
Trabalho classificado na 7ª Edição (2021) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
Diversos fatores podem influenciar o desenvolvimento de doenças inflamatórias em cães e gatos. Entre eles, estão os produtos derivados da reação de Maillard, reação não enzimática entre aminoácidos e açúcares que ocorre de maneira endógena ou durante o processamento térmico na fabricação de alimentos. Apesar desta reação conferir aspectos positivos como sabor, aroma e coloração ao alimento, ela pode proporcionar menor disponibilidade de aminoácidos, como a lisina, e a formação de produtos de glicação avançada (AGEs, do inglês advanced glycation end-products). O objetivo da presente revisão é compilar informações a partir da análise de literatura sobre a formação, os métodos de avaliação, os efeitos de produtos oriundos da reação de Maillard em alimentos para cães e gatos e potenciais métodos para redução de seus efeitos no organismo. De acordo com estudos, a avaliação da extensão da reação de Maillard em alimentos pode ser feita através da quantificação de compostos específicos tanto nos alimentos como no organismo. Alimentos úmidos, por exemplo, podem conter maiores quantidades de AGEs do que alimentos extrusados. Os AGEs promovem mudanças estruturais de proteínas e, em situações de estresse oxidativo e hiperglicemia, pode haver maior formação de AGEs endógenos, como observado em cães diabéticos. Ao interagir com receptores (RAGE) já caracterizados em cães e em seres humanos, os AGEs desencadeiam respostas inflamatórias. Em contrapartida, foi descrito em cães o RAGE solúvel (sRAGE), receptor presente na circulação sanguínea que interage com os AGEs e impede que eles se liguem ao RAGE, o que reduz o potencial de inflamação. O conhecimento gerado em estudos até o momento sugere que, para reduzir as concentrações circulantes de AGEs ou sua ligação ao RAGE, pode-se restringir seu consumo através da alimentação ou utilizar compostos que inibem sua formação, como melaço de cana, mate, resveratrol e curcumina. Apesar de serem utilizados como modelos para seres humanos, são necessários estudos em cães e gatos além dos estudos já realizados em outras espécies para a aplicação sob um ponto de vista prático, especialmente em relação a como reduzir a formação de produtos da reação de Maillard e minimizar seus potenciais efeitos inflamatórios nestas espécies.
Palavras-chave: produtos de glicação avançada; canino; felino; nutrição; inflamação.
Introdução
A expectativa de vida de cães e gatos é cada vez maior, e animais mais velhos podem apresentar alterações relacionadas à idade, que são influenciadas por fatores como imunossenescência e inflammaging, (KRAFT, 1998; DAY, 2010; BANFIELD PET HOSPITAL, 2013). O inflammaging, que em inglês é uma junção das palavras inflamação e idade, é um termo utilizado para descrever os efeitos de constantes desafios antigênicos e a consequente produção de mediadores inflamatórios que podem desencadear doenças (DAY, 2010). Diversos fatores podem ser associados às consequências da idade e de doenças crônicas, entre eles o consumo de produtos de glicação avançada (AGEs, do inglês advanced glycation end-products), que têm sido estudados como substâncias potencialmente envolvidas no desenvolvimento e progressão de doenças crônicas de cães, gatos e seres humanos (POULSEN et al., 2013; VAN ROOIJEN et al., 2013).
Grande parte dos cães e gatos consomem alimentos comerciais convencionais, como rações úmidas e extrusadas (LAFLAMME et al., 2008). Processamentos térmicos são empregados durante a fabricação destes alimentos, tais como extrusão e autoclavagem, além de processos térmicos prévios utilizados nas matérias-primas. Estes tratamentos térmicos melhoraram a digestibilidade de proteínas e de amido e aumentam a segurança microbiológica do alimento (NRC, 2006; CRANE et al., 2010). Como consequência destes processos térmicos ocorre a reação de Maillard, que confere aspectos positivos, como coloração e aroma, mas também pode apresentar consequências negativas como redução de biodisponibilidade de aminoácidos essenciais e formação de substâncias potencialmente nocivas à saúde, como os AGEs (MAILLARD, 1912; HENLE, 2005). Como alimentos comerciais podem ser fontes de produtos da reação de Maillard e são oferecidos para grande parte dos cães e gatos, o objetivo desta revisão é compilar informações sobre a formação e quantificação de produtos da reação de Maillard, como os AGEs, e apresentar os potenciais efeitos destes compostos na saúde de cães e gatos e soluções disponíveis atualmente para a redução da concentração destes compostos.
Formação de produtos da reação de Maillard
A reação de Maillard é uma reação química não enzimática entre um aminoácido e um açúcar redutor. Esta reação confere sabor, aroma e coloração ao alimento, e ocorre durante o processo de fabricação de alimentos (MAILLARD, 1912; VAN ROOIJEN et al., 2013). O esquema da reação de Maillard, com suas fases e exemplos de compostos formados, pode ser observado na Figura 1.
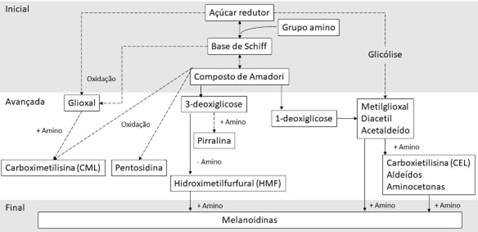
A reação de Maillard apresenta consequências como a perda de aminoácidos essenciais disponíveis no alimento, já que ocorre o bloqueio do sítio reativo do aminoácido e, assim, os derivados formados são pouco biodisponíveis, o que reduz o valor nutricional do alimento (FINOT, 2005). O grupo amina da lisina é uma das principais fontes de grupos amina reativos em proteínas de alimentos, mas as cadeias laterais de aminoácidos como arginina, histidina e triptofano também podem estar envolvidas na reação de Maillard, apesar de menos estudadas (SILVÁN et al., 2006; WILLIAMS et al., 2006; RUTHERFURD; RUTHERFURD- MARKWICK; MOUGHAN, 2007; MOUGHAN; RUTHERFURD, 2008).
Deve-se citar que a reação de Maillard não ocorre somente pelo tratamento térmico de alimentos, mas também ocorre no organismo. Em indivíduos saudáveis, proteínas endógenas podem ser glicadas, resultando na formação de AGEs. Em estudo realizado por Palaseweenun e colaboradores (2021), cães e gatos que consumiram alimentos crus e, portanto, consumiram baixos teores de AGEs provenientes da dieta, apresentaram excreção de AGEs livres na urina, o que indica produção endógena destes compostos nestas espécies.
Avaliação de produtos da reação de Maillard em alimentos para cães e gatos
Os alimentos comerciais para cães e gatos podem conter altas concentrações de AGEs, como observado por Van Rooijen e colaboradores (2014), que avaliaram a concentração de carboximetilisina (CML), frutoselisina (FL), lisinoalanina (LAL) e hidroximetilfurfural (HMF) de 67 alimentos extrusados e úmidos para cães e gatos. Não houve diferença quanto à LAL, porém alimentos úmidos apresentaram maior quantidade de CML, FL e HMF em matéria seca, com quantidades 2 a 6 vezes maiores destes compostos do que alimentos extrusados.
Um dos métodos utilizados para avaliar a absorção de AGEs é a mensuração da excreção urinária destes compostos. Van Rooijen e colaboradores (2016) avaliaram a excreção de CML, FL e LAL em gatos adultos saudáveis, e observaram correlação positiva entre o consumo de alimentos extrusados e úmidos e a excreção de CML e FL, mas não de LAL. Outro estudo recente avaliou a excreção urinária de AGEs em cães e gatos adultos (PALASEWEENUN et al., 2021). Neste estudo, 57 cães e 54 gatos sob responsabilidade de seus tutores foram incluídos e divididos de acordo com o tipo de alimentação que recebiam: alimentos crus ou alimentos comerciais. Cães e gatos que consumiram alimentos extrusados apresentaram excreção de até 3 vezes mais AGEs do que animais que consumiram alimentos crus, no caso de cães, e de até de até 4,3 vezes mais no caso de gatos. Estes estudos sugerem que cães e gatos podem absorver estes compostos pelo trato gastrointestinal e excretá-los pela urina, o que indica que os AGEs provenientes da alimentação influenciam na concentração de AGEs circulantes.
Em análises padrão de aminoácidos, os derivados formados após a reação de Maillard podem ser revertidos novamente para sua forma com grupo amina reativo. Portanto, análises específicas devem ser utilizadas para a determinação de aminoácidos com um grupo amina livre após a reação de Maillard. Há diferença entre as concentrações de lisina total (LT) e lisina reativa (LR) em alimentos para cães e gatos, e a relação entre a lisina reativa e a total pode chegar a 0,38 (WILLIAMS et al., 2006; RUTHERFURD; RUTHERFURD-MARKWICK; MOUGHAN, 2007). Além disso, é preciso levar em consideração que mesmo a LR pode não ser totalmente aproveitada. Em cães, a digestibilidade da LR observada para alimentos extrusados foi em média 88,2%, chegando a menos de 80% dependendo do alimento (HENDRIKS et al., 2013). Este fato é importante pois aponta que a análise tradicional de lisina total pode não refletir a quantidade de lisina disponível para absorção e, portanto, os fabricantes de alimentos devem garantir que a quantidade de lisina reativa, e não somente a de lisina total, supra as necessidades mínimas recomendadas para consumo diário de cães e gatos.
Efeitos dos produtos da reação de Maillard na saúde de cães e gatos
Os AGEs apresentam diversos efeitos no organismo. Eles podem ser considerados como agentes oxidativos com capacidade de modificar características físico-químicas de proteínas e, assim, modificar suas propriedades. Estas ligações cruzadas entre proteínas e AGEs são resistentes à degradação, tornando sua renovação lenta, o que faz com que AGEs se acumulem nos tecidos (VLASSARA; STRIKER, 2011). Em concentrações elevadas, os AGEs são associados a doenças tais como diabetes mellitus e osteoartrite pelas respostas inflamatórias que causam tanto em seres humanos quanto em cães (VAN ROOIJEN et al., 2013; URIBARRI et al., 2015). Em algumas situações, como na hiperglicemia, a formação de AGEs pode ocorrer de maneira mais acelerada (VAN ROOIJEN et al., 2013). Em cães, concentrações plasmáticas maiores de AGEs foram observadas em animais com diabetes mellitus quando comparados com animais saudáveis, e houve correlação positiva entre concentrações de AGEs e concentrações de glicose e de proteína (COMAZZI et al., 2008).
Os AGEs também podem estimular respostas celulares pela interação com receptores e, assim, induzir sinalização celular, ativar fatores de transcrição e consequentemente a expressão gênica. O receptor de AGEs (RAGE) é uma proteína transmembrana que faz parte da família de imunoglobulinas, e é responsável pela ativação da transcrição do fator nuclear kappa B (NF-κB), que leva à estresse oxidativo, vasoconstrição e inflamação (RAMASAMY et al., 2005). Em seres humanos, os RAGEs possuem o potencial de converter o estado inflamatório transitório em estado inflamatório contínuo, e estão presentes em diversos tipos de células, tais como monócitos, células endoteliais, células de musculatura lisa, microglia e astrócitos (THORNALLEY, 1998; BIERHAUS et al., 2005). O RAGE também já foi caracterizado na mucosa intestinal de cães, e sua expressão já foi avaliada em cães com linfoma e com sarcoma histiocítico (STERENCZAK et al., 2009, 2010, 2011; CABRERA-GARCÍA et al., 2020). Em cães com enteropatias inflamatórias crônicas (EIC), a expressão de RAGE foi maior em amostras de duodeno e cólon quando comparada àquela de cães saudáveis (CABRERA-GARCÍA et al., 2021).
As formas solúveis de RAGE (sRAGE) são biomarcadores para avaliação da gravidade de doenças, pois agem como receptores do tipo isca e, assim, inibem a ligação com o RAGE, o que reduz de forma potencial as suas consequências (MAILLARD-LEFEBVRE et al., 2009). Cães com EIC apresentaram correlação negativa entre sRAGE e escore de lesão histológica. Além disso, cães com concentrações de sRAGE menores do que 340 ng/L apresentaram lesões microscópicas de duodeno mais graves (CABRERA-GARCÍA et al., 2020). Em cães com doença inflamatória intestinal (DII), as concentrações séricas de sRAGE foram menores do que em cães saudáveis, mas não foram associadas com a gravidade das lesões histológicas (HEILMANN et al., 2014). Foi também observado aumento da concentração de sRAGE apenas em cães com remissão clínica completa de DII, enquanto cães com resposta parcial ou sem resposta ao tratamento apresentaram concentrações iguais ou reduzidas de sRAGE. Estes resultados indicam que a redução de sRAGE pode estar relacionada com doenças crônicas, mas com as evidências demonstradas até o momento, não é possível estabelecer se esta redução é a causa ou uma consequência da doença.
Métodos para a redução das concentrações de AGEs
Pouco se sabe sobre meios para reduzir de maneira eficaz as concentrações de AGEs em alimentos e no organismo. Um estudo, realizado em seres humanos com diabetes mellitus tipo 2, observou que pacientes que consumiram menor quantidade de AGEs na dieta reduziram as concentrações circulantes destas substâncias após 6 meses (LOTAN et al., 2020), indicando que o controle do consumo destes compostos através da dieta pode ter um papel importante na redução das concentrações de AGEs no organismo.
Em relação a produção de alimentos para cães e gatos, um fator que pode influenciar a formação de AGEs é a taxa de cisalhamento durante a extrusão. Maiores concentrações de CML e carboxietilisina (CEL) foram observadas em fezes de cães que receberam alimentos com alta taxa de cisalhamento do que aqueles que receberam alimento com baixa taxa de cisalhamento, o que indica que menores taxas de cisalhamento formam menos AGEs no alimento extrusado (JACKSON et al., 2020). Em relação à suplementações com potencial ação sobre os efeitos dos AGEs, um estudo recente conduzido por Price e colaboradores (2017) avaliou cães com osteoartrite suplementados com placebo e frutoborato de cálcio em baixas (60 mg/cápsula) e altas concentrações (127 mg/cápsula), com dosagem de uma ou duas cápsulas por dia dependendo da faixa de peso do animal. Cães suplementados com altas doses de frutoborato de cálcio apresentaram maiores concentrações séricas de sRAGE do que cães suplementados com placebo, o que sugere potencial de redução na inflamação e lesão de cartilagem por competição entre sRAGE e RAGE e assim redução das consequências de AGEs circulantes.
Outras substâncias que podem reduzir a formação de AGEs são compostos fenólicos, presentes em diferentes ingredientes de origem vegetal. Um estudo recente conduzido por Rebollo-Hernanz e colaboradores (2019) avaliou o efeito da película prateada do café, coproduto da produção de café para consumo humano, na formação in vitro de AGEs. O extrato desta película, que possui baixa concentração de cafeína, foi capaz de inibir a formação de AGEs. Os efeitos do melaço de cana também já foram avaliados in vitro, e este produto foi considerado eficaz na redução da produção de CEL e CML (YU; XU; YU, 2017). Outros compostos, como mate (Ilex paraguariensis) e curcumina, já foram avaliados em modelos in vitro (LUNCEFORD; GUGLIUCCI, 2005; TANG; CHEN, 2014). Além disso, o resveratrol também já foi utilizado com sucesso para a redução de AGEs em roedores (MALEKI et al., 2020). Apesar de apresentar resultados promissores, para que o uso destes compostos na alimentação de cães e gatos seja considerado seguro, estudos específicos devem ser conduzidos nestas espécies.
Considerações finais
O processo térmico é amplamente empregado na produção de alimentos para cães e gatos e, apesar de apresentar vantagens como melhora na digestibilidade de nutrientes e redução de contaminação microbiológica, pode desencadear a reação de Maillard e assim ser responsável pela produção de compostos com potencial efeito negativo, como os produtos de glicação avançada. Os estudos apontam que cães possuem receptores e respostas à AGEs semelhantes a seres humanos, e muitas vezes são utilizados como modelo de estudo para o melhor entendimento das consequências em indivíduos saudáveis e com doenças inflamatórias. Ainda são necessários mais estudos para que se possa efetuar uma intervenção adequada de um ponto de vista prático, especialmente em relação a como reduzir ou inibir a formação de produtos da reação de Maillard e assim minimizar potenciais efeitos inflamatórios que estes produtos possam desencadear em cães e gatos, bem como estudos que avaliem a ingestão de alimentos convencionais em longo prazo e os possíveis efeitos destes compostos no desenvolvimento de doenças crônicas.
Referências bibliográficas
BANFIELD PET HOSPITAL. State of Pet Health 2013 Report. [s.l: s.n.]. Disponível em: <https://www.banfield.com/state-of-pet-health>.
BIERHAUS, A. et al. Understanding RAGE, the receptor for advanced glycation end products. Journal of Molecular Medicine, v. 83, p. 876–886, 2005.
CABRERA-GARCÍA, A. I. et al. Association between serum soluble receptor for advanced glycation end-products (RAGE) deficiency and severity of clinicopathologic evidence of canine chronic inflammatory enteropathy. Journal of Veterinary Diagnostic Investigation, v. 32, n. 5, p. 664–674, 2020.
CABRERA-GARCÍA, A. I. et al. Dysregulation of gastrointestinal RAGE (receptor for advanced glycation end products) expression in dogs with chronic inflammatory enteropathy. Veterinary Immunology and Immunopathology, v. 234, p. 110216, 2021.
COMAZZI, S. et al. Advanced glycation end products and sorbitol in blood from differently compensated diabetic dogs. Research in Veterinary Science, v. 84, p. 341–346, 2008.
CRANE, S. W. et al. Commercial pet foods. In: HAND, M. S. et al. (Ed.). Small Animal Clinical Nutrition. 5. ed. Topeka, EUA: Mark Morris Institute, 2010. p. 157–190.
DAY, M. J. Ageing, immunosenescence and inflammageing in the dog and cat.
Journal of Comparative Pathology, v. 142, p. S60–S69, 2010.
FINOT, P.-A. The absorption and metabolism of modified amino acids in processed foods. Journal of AOAC International, v. 88, n. 3, p. 894–903, 2005.
HEILMANN, R. M. et al. Systemic levels of the anti-inflammatory decoy receptor soluble RAGE (receptor for advanced glycation end products) are decreased in dogs with inflammatory bowel disease. Veterinary Immunology and Immunopathology, v. 161, p. 184–192, 2014.
HENDRIKS, W. H. et al. Comparison of ileal and total tract nutrient digestibility of dry dog foods. Journal of Animal Science, v. 91, n. 8, p. 3807–3814, 1 ago.
2013.
HENLE, T. Protein-bound advanced glycation endproducts (AGEs) as bioactive amino acid derivatives in foods. Amino Acids, v. 29, p. 313–322, 2005.
JACKSON, M. I. et al. Consumption of identically formulated foods extruded under low and high shear force reveals that microbiome redox ratios accompany canine immunoglobulin A production. Journal of Animal Physiology and Animal Nutrition, v. 104, p. 1551–1567, 2020.
KRAFT, W. Geriatrics in canine and feline internal medicine. European Journal of Medical Research, v. 3, n. 1–2, p. 31–41, 21 fev. 1998.
LAFLAMME, D. P. et al. Pet feeding practices of dog and cat owners in the United States and Australia. Journal of the American Veterinary Medical Association, v. 232, n. 5, p. 687–694, 2008.
LOTAN, R. et al. Long term dietary restriction of advanced glycation end-products
(Ages) in older adults with type 2 diabetes is feasible and efficacious-results from a pilot RCT. Nutrients, v. 12, p. 1–13, 2020.
LUNCEFORD, N.; GUGLIUCCI, A. Ilex paraguariensis extracts inhibit AGE formation more efficiently than green tea. Fitoterapia, v. 76, p. 419–427, 2005.
MAILLARD-LEFEBVRE, H. et al. Soluble receptor for advanced glycation end products: a new biomarker in diagnosis and prognosis of chronic inflammatory diseases. Rheumatology, v. 48, p. 1190–1196, 2009.
MAILLARD, L. C. Action des acides aminés sur les sucres: formation des mélanoidines par voie méthodique. Comptes Rendus Hebdomadaires Des Seances De l’Academie Des Sciences, v. 154, p. 66–68, 1912. Disponível em:
<https://gallica.bnf.fr/ark:/12148/cb343481087/date1912>.
MALEKI, V. et al. The effect of resveratrol on advanced glycation end products in diabetes mellitus: a systematic review. Archives of Physiology and Biochemistry, v. 0, p. 1–8, 2020.
MOUGHAN, P. J.; RUTHERFURD, S. M. Available lysine in foods: A brief historical overview. Journal of AOAC International, v. 91, n. 4, p. 901–906, 2008.
NRC. Nutrient Requirements of Dogs and Cats. 1. ed. Washington, D.C.: National Academy Press, 2006.
PALASEWEENUN, P. et al. Urinary excretion of advanced glycation end products in dogs and cats. Journal of Animal Physiology and Animal Nutrition, v. 105, p. 149–156, 2021.
POULSEN, M. W. et al. Advanced glycation endproducts in food and their effects on health. Food and Chemical Toxicology, v. 60, p. 10–37, 2013.
PRICE, A. K. et al. Effects of dietary calcium fructoborate supplementation on joint comfort and flexibility and serum inflammatory markers in dogs with osteoarthritis. Journal of Animal Science, v. 95, p. 2907–2916, 2017.
RAMASAMY, R. et al. Advanced glycation end products and RAGE: a common thread in aging, diabetes, neurodegeneration, and inflammation. Glycobiology, v. 15, n. 7, p. 16R-28R, 2005.
REBOLLO-HERNANZ, M. et al. Inhibition of the Maillard reaction by phytochemicals composing an aqueous coffee silverskin extract via a mixed mechanism of action. Foods, v. 8, p. 1–21, 2019.
RUTHERFURD, S. M.; RUTHERFURD-MARKWICK, K. J.; MOUGHAN, P. J.
Available (ileal digestible reactive) lysine in selected pet foods. Journal of Agricultural and Food Chemistry, v. 55, p. 3517–3522, 2007.
SILVÁN, J. M. et al. Analysis and biological properties of amino acid derivates formed by Maillard reaction in foods. Journal of Pharmaceutical and Biomedical Analysis, v. 41, p. 1543–1551, 2006.
STERENCZAK, K. A. et al. Cloning, characterisation, and comparative quantitative expression analyses of receptor for advanced glycation end products (RAGE) transcript forms. Gene, v. 434, p. 35–42, 2009.
STERENCZAK, K. A. et al. High-mobility group B1 (HMGBl) and receptor for advanced glycation end-products (RAGE) expression in canine lymphoma. Anticancer Research, v. 30, p. 5043–5048, 2010.
STERENCZAK, K. A. et al. Quantitative PCR and immunohistochemical analyses of HMGB1 and RAGE expression in canine disseminated histiocytic sarcoma (malignant histiocytosis). Anticancer Research, v. 31, p. 1541–1548, 2011.
TANG, Y.; CHEN, A. Curcumin eliminates the effect of advanced glycation end- products (AGEs) on the divergent regulation of gene expression of receptors of AGEs by interrupting leptin signaling. Laboratory Investigation, v. 94, p. 503– 516, 2014.
THORNALLEY, P. J. Cell activation by glycated proteins. AGE receptors, receptor recognition factors and functional classification of AGEs. Cellular and Molecular Biology, v. 44, n. 7, p. 1013–1023, 1998.
URIBARRI, J. et al. Dietary advanced glycation end products and their role in health and disease. Advances in Nutrition, v. 6, p. 461–473, 2015.
VAN ROOIJEN, C. et al. The Maillard reaction and pet food processing: Effects on nutritive value and pet health. Nutrition Research Reviews, v. 26, p. 130–148, 2013.
VAN ROOIJEN, C. et al. Quantitation of Maillard reaction products in commercially available pet foods. Journal of Agricultural and Food Chemistry, v. 62, p.
8883–8891, 2014.
VAN ROOIJEN, C. et al. Urinary excretion of dietary Maillard reaction products in healthy adult female cats. Journal of Animal Science, v. 94, n. 1, p. 185–195, 2016.
VLASSARA, H.; STRIKER, G. E. AGE restriction in diabetes mellitus: a paradigm shift. Nature Reviews Endocrinology, v. 7, n. 9, p. 526–539, 2011.
WILLIAMS, P. A. et al. Lysine content in canine diets can be severely heat damaged. Journal of Nutrition, v. 136, p. 1998S-2000S, 2006.
YU, P.; XU, X. B.; YU, S. J. Inhibitory effect of sugarcane molasses extract on the formation of Nε-(carboxymethyl)lysine and Nε-(carboxyethyl)lysine. Food Chemistry, v. 221, p. 1145–1150, 2017.







