

Orientador(a): Márcio Antonio Brunetto
Instituição: FMVZ USP
1º Colocado na 9ª Edição (2023) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
Os avanços no desenvolvimento da inteligência artificial (IA) estão proporcionando diversas mudanças na medicina por ser capaz de avaliar grandes quantidades de dados complexos em tempo reduzido, em comparação à habilidade humana. Uma das suas aplicações mais recentes se deu na doença inflamatória intestinal (DII) como uma ferramenta valiosa no diagnóstico, análise de dados biológicos ou, até mesmo, de imagens de histologia ou endoscopia. A partir dela é possível identificar biomarcadores nas diferentes fases da doença, severidade e eficiência de tratamento. Este recurso, entretanto, ainda não foi explorado na DII de cães, na medicina veterinária. A DII é a doença gastrintestinal crônica mais comum em cães e gatos. Há consenso na literatura sobre a existência de disbiose como um dos principais fatores associados à doença. Dado que os prebióticos apresentam potencial de melhorar a disbiose intestinal nestes casos, estudos que avaliem essa possibilidade em prol da promoção da eubiose são necessários. Assim, o presente estudo objetivou avaliar os efeitos da suplementação de parede celular de levedura (PCL), um prebiótico, na microbiota fecal de cães com DII com resultados avaliados por meio de IA. Foram incluídos doze cães (n=12) com DII controlada, subdivididos em grupo teste (PCL; n=6) e grupo controle (CON; n=6). Os animais foram suplementados, durante 60 dias, com 13,14 ± 2,01 mg/kg de PCL em cápsula (grupo PCL) ou placebo (grupo COM), com cápsulas adicionadas de alimento triturado, por via oral. O software de IA concluiu que o tratamento com PCL foi eficaz em reduzir a disbiose, aumentar os grupos bacterianos associados à melhora do quadro inflamatório e reduzir aqueles relacionados à pior evolução da DII. As bactérias Collinsella aerofaciens, Clostridium ramosum e Lactonifactor spp. foram identificadas como marcadores da doença e o gênero Blautia spp. e a família Veillonellaceae foram identificadas como marcadores do tratamento com PCL.
Palavras-chave: canino, enteropatia crônica, IA
Introdução
A revista Forbes publicada em janeiro deste ano postulou que 2023 será um ano definitivo à inteligência artificial (IA) e representará um marco na forma de trabalho (CENK SIDAR, 2023). Os órgãos governamentais e indústrias do mundo todo demonstraram-se ansiosos em apoiar a IA devido ao seu potencial impacto benéfico em diversas áreas da sociedade. O governo americano, por exemplo, chegou a investir US$ 4,98 bilhões em pesquisa e desenvolvimento de IA em 2020 para aplicação em diferentes áreas, dentre elas, a medicina (CHEUNG; LIN, 2023). A habilidade humana é limitada em certo pontos que comprometem os avanços científicos relacionados à interpretação de grandes quantidades de dados complexos. O uso da IA tem a vantagem de otimizar a interpretação de dados robustos aliada ao mecanismo de aprendizado automatizado (por máquinas), que otimizam a conclusão, interpretação e estabelece relações com os dados fornecidos não dependentes da aptidão humana. A inteligência artificial surge com a promessa de remodelar a forma de aplicação da medicina baseada em evidências (PANCH; SZOLOVITS; ATUN, 2018; RAJPURKAR et al., 2022).
É possível dizer que as pesquisas médicas buscam resolver questões no âmbito do diagnóstico, tratamento e cura de doenças complexas como, a doença inflamatória intestinal (DII), cujos estudos norteiam a compreensão da disbiose intestinal uma vez que é reconhecida como ponto crítico desta enfermidade (DAVENPORT; JERGENS; REMMILARD, 2010; RAJPURKAR et al., 2022).
A microbiota intestinal é composta por, em média, 100 trilhões de bactérias que desenvolvem relação simbiôntica com o hospedeiro (SUCHODOLSKI, 2011). Quando estas são analisadas, grandes quantidades de dados de sequenciamento genético são obtidos e precisam ser avaliados por um sistema modernizado. Este deve possibilitar o refinamento de resultados ao ponto de convergir em soluções terapêuticas, prognósticas e diagnósticas com poucos vieses metodológicos para serem aplicadas na rotina clínica baseada em evidências.
À luz da crescente importância dos cães na família, o crescimento da medicina veterinária fomentou o desdobramento das pesquisas na sua área e, principalmente, viabilizou aquelas cujas doenças se sobrepõe com os seres humanos, como a DII (VÁZQUEZ-BAEZA et al., 2016).
Dados da literatura humana, veterinária e de pesquisas em modelos animais já confirmaram o potencial dos prebióticos como terapia coadjuvante da DII. O uso deles é atribuído a um cenário otimista por ajudarem no controle da doença, aumentar o tempo de remissão dos sinais clínicos, severidade e, consequentemente, intervenções farmacológicas. A atuação deles permeia, essencialmente, a modulação da microbiota intestinal (RICHMAN; RHODES, 2013; SPAGNUOLO et al., 2017), objeto de estudo na grande maioria das pesquisas atuais. Portanto, o presente estudo objetivou avaliar a microbiota de cães com DII controlada suplementados com PCL por meio de uma ferramenta de IA.
Material e Métodos
Foram selecionados cães com DII confirmada por histopatológico em fase controlada da doença (Canine Chronic Enteropathy Activity Index Score ≤ 3) (ALLENSPACH et al., 2007), adultos com escore de condição corporal ideal (LAFLAMME, 1997), sem afecções concomitantes, após exclusão dos diagnósticos diferenciais (DAVENPORT et al., 2010) , tratados somente com ciclosporina. Não foram realizadas alterações no tratamento durante o estudo e, animais em tratamento com antibióticos, prebióticos, probióticos ou corticoide nos 30 dias prévios ao início do estudo também não foram incluídos. Os doze animais selecionados foram adaptados por 30 dias a mesma dieta hipoalergênica com proteína hidrolisada e esta foi mantida durante todo o período experimental. Os diagnósticos diferenciais de parasitose intestinal, hipoadrenocorticismo e alergia alimentar foram realizados antes do procedimento de endoscopia e colonoscopia.
Os animais compuseram dois grupos experimentais que receberam cápsulas com PCL (n=6) ou alimento comercial hipoalergênico triturado como placebo (o mesmo utilizado para alimentação) para constituir o grupo controle (CON; n=6), em delineamento randomizado e duplo-cego. Os cães do grupo PCL ingeriram a dose correspondente de 13,14 ± 2,01mg/kg do prebiótico. As fezes foram coletadas no tempo 0 (T0) (prévio ao início da suplementação e passados os 30 dias de padronização da dieta) e no tempo 60 (T60) (após 60 dias de suplementação) e armazenadas em -80°C até análise (ALLENSPACH et al., 2019). O sequenciamento da microbiota foi realizado pelo método Illumina® e os resultados brutos foram analisados no software de IA EZbiome®. As sequencias foram filtradas por um escore de acurácia das leituras dos pares de bases (QPHRED) para atingir 99% de confiabilidade. Este software calculou a relação Firmicutes/Bacteroidetes, mapeou as unidades operacionais taxonômicas em nível de filo, gênero e espécie. Também foram calculados os índices de diversidade alfa Simpson e Shannon e a análise linear discriminante do tamanho do efeito (LEfSe) foi utilizada para a identificação de biomarcadores da doença e associados ao melhor tratamento. Para as demais análises de comparação de médias, o teste de Tukey foi aplicado e valores de p<1,0% foram considerados significativos.
Resultados e Discussão
Os cães inclusos na análise apresentaram, em média, idade de 5,83±2,61 anos; peso corporal de 13,12±7,6 kg; ECC 4,9±0,3 e escore de massa muscular (EMM) 2,75±0,37. De forma geral, o CCECAI manteve-se dentro da classificação (entre 0 e 3 – enteropatia clinicamente controlada), durante todo o período experimental e suas características fenotípicas também não mudaram.
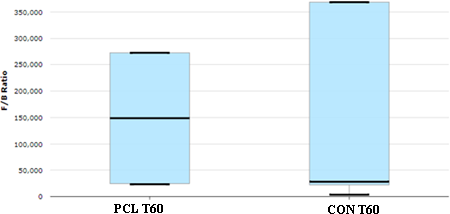
O software de IA identificou que o tratamento PCL apresentou potencial em conduzir o cenário de disbiose para a eubiose. A relação Firmicutes/Bacteroidetes é um indicador inicial da disbiose onde a redução indica piora (FRANK et al., 2007; FRIES; COMUNALE, 2011). Os Firmicutes são conhecidos por beneficiarem a saúde da mucosa, pois estão envolvidos na produção de butirato (NAGAO- KITAMOTO; KAMADA, 2017). A relação Firmicutes/Bacteroidetes foi melhor no grupo tratado com parede celular de levedura (Figura 1).
Os gêneros encontrados em maior abundância em ambos os grupos foram Terrisporobacter spp., Paeniclostridium spp., Rombutsia spp., Catenibacterium spp., Streptococcus spp., Collinsella spp., Clostridioides spp. (Figura 2). Entre eles, destacaram-se a evolução dos três primeiros.
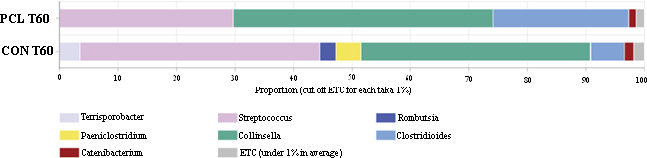
O gênero Terrisporobacter spp. pertence ao filo Firmicutes, o qual está envolvido na produção de ácidos graxos de cadeia curta (AGCC) (GERRITSEN et al., 2014; NIU et al., 2022), principal fonte de energia para os colonócitos. Além disso, favorecem a produção de mucina e possuem potencial envolvimento na regulação do sistema imunológico e na permeabilidade seletiva intestinal (HOLSCHER, 2017; MIYAMOTO et al., 2018).
Os AGCC foram avaliados no presente estudo (dados não publicados) e não diferiram. Estes foram mensurados em fezes, embora acredita-se atualmente que a mensuração plasmática seja mais fidedigna, já que são absorvidos rapidamente pela mucosa intestinal para produzirem seus efeitos (SWANSON et al., 2002).
Sukhina et al. (2022) apontaram em seu atual estudo a presença desta bactéria como biomarcador da doença inflamatória intestinal em humanos e, o mesmo não fora observado em pessoas saudáveis. Este dado é coerente com os resultados do presente trabalho, no qual este gênero bacteriano foi identificado e sua população aumentou ao longo do tempo no grupo controle e, reduziu no grupo tratado, o que pode demonstrar que a modulação intestinal evoluiu no sentido da normalidade ou melhora.
Por outro lado, as bactérias do gênero Paeniclostridium spp. e Romboutsia spp. são conhecidas por ter grande potencial inflamatório e de lesão epitelial, com especial atenção para a P. sordelli, por exemplo, que produz uma toxina hemorrágica envolvida na gênese da enterite necrótica e ulcerativa em diversas espécies animais (NYAOKE et al., 2020; LI et al., 2022). De forma semelhante, as bactérias Romboutsia spp. são reconhecidas como “patobiontes” e frequentemente observadas em maior abundância em humanos com colite ulcerativa. A redução da sua população foi associada com alguns tratamentos antinflamatórios bem sucedidos (WU et al., 2021; WANG et al., 2022, 2023). A presença destes gêneros bacterianos somente no grupo placebo corrobora a teoria de que o tratamento com PCL foi benéfico e a doença continuou a evoluir no grupo controle ou placebo.
De forma geral, o grupo PCL apresentou 4,0% menos gêneros bacterianos. É possível que a modulação tenha se iniciado pelo desaparecimento de bactérias patogênicas. Não foram observadas diferenças nos índices de diversidade alfa Simpson e Shannon, o que endossa estes resultados.
Os grupos taxonômicos Blautia spp. (Blautia glucerasea) e Vellionellales (Veillonellaceae) foram identificados como biomarcadores do tratamento com PCL, e Collinsella aerofaciens, Lactonifactor spp. e Clostridium ramosum como marcadoras da DII (Figura 3).
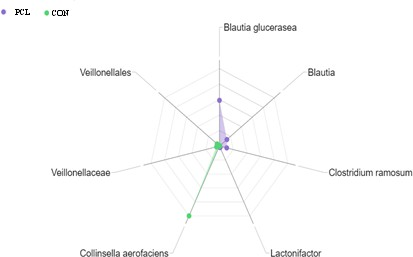
O gênero de bactérias Blautia spp. é reconhecido por aliviar sinais de doenças inflamatórias como doença de Crohn, colite ulcerativa ou câncer de cólon e reto em humanos e, na DII em cães. A sua redução indica piora da inflamação (MINAMOTO et al., 2015; LIU et al., 2021), pois estão envolvidas na produção de butirato e promovem dehidroxilação de ácidos biliares (TAKAHASHI et al., 2016; LIU et al., 2021). Pouco se sabe sobre a espécie B. glucerasea e, os poucos relatos apontam sua potencial atuação na hidrólise de glicosilceramidas de plantas em substâncias como os esfingolípides que previnem o câncer de cólon (LIU et al., 2021).
O aumento das bactérias do grupo Veillonellaceae já foi sugerido como biomarcador da DII em humanos (GEVERS et al., 2014) associado a redução de Bacteroidetes (MAIOLI et al., 2022). A sua redução, portanto, é favorável e pode ser obtida por meio do fornecimento oral de PCL, como observado no presente estudo.
Por outro lado, as bactérias Clostridium ramosum foram associadas à metaplasia maligna. Elas são capazes de produzir proteases de IgA e aumentam a possibilidade de adesão bacteriana à mucosa (LEGARIA et al., 2020). O gênero Lactonifactor spp. tem apenas uma espécie, a Lactonifactor longoviformis que demonstrou potencial em metabolizar lignina até enterolignanos e, possui efeito antioxidante e protetor contra o câncer de cólon em humanos (RAFFAELLI; HOIKKALA; LEPPÄLÄ, 2002; MABROK et al., 2012). Ambas ainda não tiveram seu papel reportado pela literatura em cães com DII, sendo este um achado apontado no presente estudo.
Por fim, as bactérias Collinsella aerofaciens foram/são relacionadas à DII em cães, doença de Crohn e colite ulcerativa em humanos. De acordo com Soontararak et al. (2019) em cães, esta espécie correlacionou-se com a piora clínica da doença. Elas favorecem a transcrição de IL-17, citocina que apresenta alto potencial para promoção de injúria tecidual e perda de permeabilidade intestinal (VIJAY; VALDES, 2022).
Conclusão
O uso da IA foi capaz de identificar que o fornecimento de PCL na dose de 13,14 ± 2,01 mg/kg de peso corporal favoreceu a modulação da microbiota com tendência de evolução à eubiose. Bactérias associadas à inflamação de mucosa na DII, foram observadas no grupo controle, enquanto bactérias simbiontes cresceram com o tratamento PCL. As bactérias Collinsella aerofaciens, Clostridium ramosum e Lactonifactor spp. foram identificadas como marcadores da doença. Estes resultados são inéditos, corroboram alguns dados publicados na literatura e podem nortear pesquisas futuras com maior acurácia.
Referências bibliográficas
ALLENSPACH, K. et al. Chronic enteropathies in dogs: Evaluation of risk factors for negative outcome. Journal of Veterinary Internal Medicine, v. 21, n. 4, p. 700– 708, 2007.
ALLENSPACH, K. A. et al. Correlating Gastrointestinal Histopathologic Changes to Clinical Disease Activity in Dogs With Idiopathic Inflammatory Bowel Disease. Veterinary pathology, v. 56, n. 3, p. 435–443, 2019.
CENK SIDAR. 2023 Will Be A Defining Year For AI And The Future Of Work. Disponível em: <https://www.forbes.com/sites/forbestechcouncil/2023/01/25/2023- will-be-a-defining-year-for-ai-and-the-future-of-work/?sh=1ffdc720218b>.
CHEUNG, H.; LIN, Y. Machine Learning on Microbiome Research in Gastrointestinal Cancer. Microbiome in Gastrointestinal Cancer, v. 36, n. 4, p. 193–200, 2023.
DAVENPORT, D. J.; JERGENS, A. E.; REMMILARD, R. . Inflammatory bowel disease. In: HAND, M. S. et al. (Ed.). Small Animal Clinical Nutritional. 5. ed. Topeka: Mark Morris Institute, 2010. p. 1065–1076.
GERRITSEN, J. et al. Characterization of Romboutsia ilealis gen. nov., sp. nov., isolated from the gastro-intestinal tract of a rat, and proposal for the reclassification of five closely related members of the genus Clostridium into the genera Romboutsia gen. nov., Intestinib. International Journal of Systematic and Evolutionary Microbiology, v. 64, p. 1600–1616, 2014.
GEVERS, D. et al. The treatment-naive microbiome in new-onset Crohn’s disease. Cell Host and Microbe, v. 15, n. 3, p. 382–392, 2014.
HOLSCHER, H. D. Dietary fiber and prebiotics and the gastrointestinal microbiota. Gut Microbes, v. 8 (2), p. 172-184, 2017.
LAFLAMME, D. Development and validation of a body condition score system for dogs. Canine Practice, v. 22, n. 4, p. 10–15, 1997.
LEGARIA, M. C. et al. Clostridium ramosum rapidly identified by MALDI-TOF MS. A rare gram-variable agent of bacteraemia. Access Microbiology, v. 2, n. 8, 2020.
LI, X. et al. Paeniclostridium sordellii hemorrhagic toxin targets TMPRSS2 to induce colonic epithelial lesions. Nature Communications, v. 13, n. 1, 2022.
LIU, X. et al. Blautia—a new functional genus with potential probiotic properties? Gut Microbes, 13 (1), p. 1-21, 2021.
MABROK, H. B. et al. Lignan transformation by gut bacteria lowers tumor burden in a gnotobiotic rat model of breast cancer. Carcinogenesis, v. 33, n. 1, p. 203–208, 2012.
MAIOLI, T. U. et al. Non-pharmacologic strategies for the management of intestinal inflammation. Biomedicine and Pharmacotherapy, v. 145, 2022.
MINAMOTO, Y. et al. Alteration of the fecal microbiota and serum metabolite profiles in dogs with idiopathic inflammatory bowel disease. Gut Microbes, v. 6, n. 1, p. 33– 47, jan. 2015.
MIYAMOTO, J. et al. Barley β-glucan improves metabolic condition via short-chain fatty acids produced by gut microbial fermentation in high fat diet fed mice. PLoS ONE, v. 13, n. 4, p. e0196579, 2018.
NIU, J. et al. Effects of Silage Diet on Meat Quality through Shaping Gut Microbiota in Finishing Pigs. Microbiology Spectrum, v. 11, n. 1, p. e02416-22, 2022.
NYAOKE, A. C. et al. Paeniclostridium (Clostridium) sordellii–associated enterocolitis in 7 horses. Journal of Veterinary Diagnostic Investigation, v. 32, 2, p. 239–245, 2020.
PANCH, T.; SZOLOVITS, P.; ATUN, R. Artificial intelligence, machine learning and health systems. Journal of Global Health, v. 8, n. 2, 2018.
RAFFAELLI B, HOIKKALA A, LEPPÄLÄ E, W. K. Enterolignans. Biomed Life Sci, 25, n. 777, p. 29–43, 2002.
RAJPURKAR, P. et al. AI in health and medicine. Nature Medicine, v. 28, n. 1, p. 31–38, 2022.
RICHMAN, E.; RHODES, J. M. Review Article: Evidence-Based Dietary Advice for Patients with Inflammatory Bowel Disease. Alimentary Pharmacology and Therapeutics, v. 38, n. 10, p. 1156–1171, 2013.
SOONTARARAK, S. et al. Humoral immune responses against gut bacteria in dogs with inflammatory bowel disease. PLoS ONE, v. 14, n. 8, 2019.
SPAGNUOLO, R. et al. Beta-Glucan, Inositol and Digestive Enzymes Improve Quality of Life of Patients with Inflammatory Bowel Disease and Irritable Bowel Syndrome. European Review for Medical and Pharmacological Sciences, v. 21, 2, p. 102–107, 2017.
SUCHODOLSKI, J. S. Microbes and gastrointestinal health of dogs and cats. Journal of Animal Science, v. 89, n. 5, p. 1520–1530, 2011.
SUKHINA, M. A. et al. Peculiarities of Microbiota in Patients with Inflammatory Intestinal Diseases. Vestnik Rossiiskoi Akademii Meditsinskikh Nauk, v. 77, n. 3, p. 165–171, 2022.
SWANSON, K. S. et al. Supplemental fructooligosaccharides and mannanoligosaccharides influence immune function, ileal and total tract nutrient digestibilities, microbial populations and concentrations of protein catabolites in the large bowel of dogs. Journal of Nutrition, v. 132, n. 5, p. 980–989, 2002..
TAKAHASHI, K. et al. Reduced Abundance of Butyrate-Producing Bacteria Species in the Fecal Microbial Community in Crohn’s Disease. Digestion, v. 93, p. 59–65, 2016.
VÁZQUEZ-BAEZA, Y. et al. Dog and human inflammatory bowel disease rely on overlapping yet distinct dysbiosis networks. Nature Microbiology, v. 1, 2016.
VIJAY, A.; VALDES, A. M. Role of the gut microbiome in chronic diseases: a narrative review. European Journal of Clinical Nutrition, v. 76, n. 4, p. 489–501, 2022.
WANG, H. G. et al. Cepharanthine ameliorates dextran sulphate sodium-induced colitis through modulating gut microbiota. Microbial Biotechnology, v. 15, n. 8, p. 2208–2222, 2022.
WANG, K. et al. κ-Selenocarrageenan Oligosaccharides Prepared by Deep-Sea Enzyme Alleviate Inflammatory Responses and Modulate Gut Microbiota in Ulcerative Colitis Mice. International Journal of Molecular Sciences, v. 24, n. 5, 2023.
WU, Z. et al. Selenium-Enriched Lactobacillus acidophilus Ameliorates Dextran Sulfate Sodium-Induced Chronic Colitis in Mice by Regulating Inflammatory Cytokines and Intestinal Microbiota. Frontiers in Medicine, v. 8, 2021.





