

Orientador(a): Maria Anete Lallo
Instituição: Universidade Paulista – UNIP – São Paulo
Trabalho Classificado na 10ª Edição (2024) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A colite granulomatosa é uma doença infecciosa e inflamatória que acomete o cólon e eventualmente se estende ao íleo sobretudo em cães das raças Boxer e Bulldog Francês. Ao contrário da maioria das colites crônicas em pequenos animais, a colite granulomatosa – também denominada colite ulcerativa – pode se manifestar em pacientes jovens, dado este que reforça a sugestão de sua etiologia genética. A causa consiste na proliferação de Escherichia coli (variante entero-invasiva) que infecta o cólon em detrimento de bactérias desejadas de modo a conferir o aspecto infeccioso da doença que estará associada a disbiose secundária e inflamação crônico-ativa mediada por histiócitos e outros infiltrados leucocitários. Clinicamente os animais apresentam diarreia crônica dotada de sangue e muco abundantes, tenesmo e dor são frequentes e a depender da gravidade do quadro cursam para perda de peso. O diagnóstico final depende do histórico clínico (diarreia com hematoquezia), achados macroscópicos da colonoscopia (edema, úlceras e hiperplasia de parede), histopatologia (presença de histiócitos) somados ao crescimento de E. coli em cultura de um fragmento de cólon. O tratamento é direcionado pelo antibiograma do cólon, portanto voltado ao uso prolongado de antibiótico. O transplante de microbiota fecal vem sendo evidenciado como tratamento – protagonista ou adjuvante – para enterites agudas (parvovirose canina), disbioses e enteropatias crônicas, mas pouco foi explorado no intuito de modular a microbiota e com isso reduzir inflamação na colite granulomatosa e almejar reduzir os cursos de antimicrobianos, garantindo menores intervalos entre recidivas nos animais com colite ulcerativa. O objetivo deste relato foi apresentar um caso de colite ulcerativa com resistência aos antibióticos usuais – sensível e dependente apenas de Amicacina – e que exibiu controle das recidivas e manutenção de um bom escore fecal a partir do emprego de transplante fecal poupando-o de novo curso de antibiótico e garantindo melhora tanto do ponto de vista clínico quanto do microbioma.
Palavras-chaves: cães; colite; microbioma.
Introdução
Descrita pela primeira vez em 1965 nos Estados Unidos, a colite ulcerativa ainda é uma doença emergente (VAN KRUININGEN, 1967). O quadro pode ser confundido com outras doenças diante das manifestações inespecíficas e isto pode atrasar o diagnóstico e conferir maior cronicidade. O fato do Bulldog Francês ser atualmente uma das raças mais populares no Brasil está impactando na alta incidência da afecção que era em princípio mais popular na raça Boxer. Vale considerar uma adequada triagem para todo animal jovem que traga histórico de diarreia crônica, como: parasitismo; enterites virais e bacterianas; hipersensibilidade alimentar; insuficiência pancreática exócrina; corpo estranho no trato gastrointestinal e outras possibilidades causais (LECHOWSKI et al, 2013; KEINER et al., 2021; ROMANO et al, 2021).
Outras raças de cães foram descritas, como: Malamute do Alaska, Mastiff Inglês, American Staffordshire Terrier, Teckel e Bulldog Inglês (ARGENTA et al, 2018). Mais recentemente também foi relatada em um gato (MATSUMOTO et al, 2019). Predisposição genética é plausível, mas ainda não delimitada (ARGENTA, 2018, KEINER et al, 2021).
A doença tem causa bacteriana a partir da infecção por E. coli, agente da microbiota que pode ser um achado irrelevante em condições de eubiose, contudo, neste quadro existe provável variação genética do patógeno que rebuscou sua patogenicidade e sua virulência, conferindo-lhe potencial de invasão e mecanismos de evasão imunológica que podem justificar a cronicidade do quadro inflamatório- infeccioso e a resistência aos tratamentos antimicrobianos (DAVIES et al, 2004; KEINER et al, 2021; MANCHESTER et al, 2021).
Clinicamente os animais exibem diarreia acompanhada de sangue, muco e há importante tenesmo. Podem portar empachamento e flatulências. Eventualmente apresentam vômitos, perda de peso e prostração. O apetite é variável (DAVIS et al, 2004; KEINER et al, 2021; MANCHESTER et al, 2021, MANCHESTER et al, 2023; NOLTE et al, 2023).
Nos exames séricos os achados podem ser variados ou até ausentes. Anemia, neutrofilia, aumento de ureia, monocitose, hipocobalaminemia e outras alterações sugestivas de perda sanguínea, disbiose e inflamação, são incertas. Os achados típicos de disabsorção intestinal – frequentes em doenças do intestino delgado – como hipoalbuminemia e hipocalcemia podem ou não estar presentes (KATHER et al, 2020; MANCHESTER et al, 2023; NOLTE et al, 2023).
Na ultrassonografia pode-se avaliar a motilidade, espessamento parietal do intestino (embora o cólon receba uma avaliação limitada no exame ultrassonográfico), distensão gasosa e outras informações dependentes da gravidade (COSTA e ROMANO, 2022). O exame permite colaborar na exclusão de corpos estranhos e outras condições indesejadas (hepáticas, renais e pancreáticas). O uso de contrastes – embora incomum – pode favorecer o diagnóstico (CORDELLA et al, 2021; KEINER, 2021).
A colonoscopia é o exame de eleição que permite avaliação intraluminal visando notar achados macroscópicos (danos estruturais comuns na colite ulcerativa) e coletar amostras da mucosa de cólon e se possível íleo para exames de histopatologia e de cultura com antibiograma (KEINER et al, 2021; COSTA e ROMANO, 2022; MANCHESTER et al, 2023). As colorações histológicas empregadas são Hematoxilina-Eosina (H.E.) e principalmente Ácido Periódico de Schiff (P.A.S.) que permitem avaliar se existe e quão marcante é o infiltrado de linfócitos e histiocítico associado a marcação de macrófagos, certamente garantir diferenciais de enterites infrequentes como àquelas causadas por fungos ou Leishmania sp. (CASANOVA et al, 2019; COSTA e ROMANO, 2022; NOLTE et al, 2023). A imunoistoquímica foi descrita como método diagnóstico em casos específicos (ISHII, et al, 2022).
O antibiótico é o principal tratamento da doença e seu uso tende a ser estendido. Existe uma problemática acerca da notável redução da eficácia dos antimicrobianos comumente usados contra essa bactéria como Enrofloxacino e acredita-se que isso se deve a resistência do patógeno. Quase sempre será preciso um curso de 30 a 90 dias de antibiótico com base na cultura de cólon e isto requer monitoração (efeitos colaterais). Autores referiram eficácia através da Amicacina em alguns casos em que outros fármacos foram ineficazes, todavia sabe-se do potencial nefrotóxico deste medicamento (ARGENTA et al, 2018; KEINER et al, 2021; COSTA e ROMANO, 2022; MANCHESTER et al, 2023).
Não há elevada evidência científica – por enquanto – acerca do papel curativo ou paliativo de probióticos para esta afecção (DAVIES et al, 2004; STAVROULAKI et al, 2023; YANG e WU, 2023).
Dieta hidrolisada e/ou enriquecida por fibras pode ser adjuvante visando variados benefícios (alta digestibilidade, alto teor energético, efeito prebiotico, menor estímulo alergênico no trato gastrointestinal, melhoria da motilidade). Não há qualquer evidência científica quanto a superioridade da alimentação natural (caseira) em detrimento da alimentação comercial industrializada (ração) então essa determinação deve ser considerada com base no perfil do tutor e com base no paciente, ou seja, fatores individuais (ROMANO et al, 2021; COSTA e ROMANO, 2022, MANCHESTER et al, 2023).
O uso de antinflamatórios não é essencial, porém pode abrandar sinais e sintomas. A Mesalazina é um Salicilato (antinflamatório não esteroidal) amplamente empregado em cães com colites crônicas de causa não infecciosa. Os glicocorticóides como a Prednisolona e os imunossupressores como a Ciclosporina não são obrigatórios na maioria das vezes (SUGITA et al, 2021), embora possam reduzir a inflamação e garantir maior apetite em casos específicos, especialmente nos cães com doença inflamatória intestinal associada (DAVIES et al, 2004; LECHOWSKI et al, 2013; ROMANO et al, 2021; COSTA e ROMANO, 2022).
A cura clínica é possível quando há resposta adequada ao antimicrobiano, contudo, recidivas são comuns e isso torna o prognóstico reservado. Há casos em que a estabilização clínica não é alcançada e isto alerta o quanto a pesquisa científica deve dedicar-se em prol de terapias inovadoras (DAVIES et al, 2004; KEINER et al, 2021; MANCHESTER et al, 2021).
Relato de caso
Um paciente canino da raça Bulldog Francês com um ano e meio de idade, foi atendido mediante histórico de magreza (escore 3/9), hematoquezia crônica e acentuada, tenesmo e flatulências. Mediante uma triagem de exclusão que não apontou uma causa e diante da pouca resposta a dieta hidrolisada, o animal foi encaminhado ao diagnóstico por colonoscopia que apontou colite granulomatosa (cultura aeróbia de cólon positiva para E. coli e colorações histológicas positivas para marcação de macrófagos e presença de histiócitos). O tratamento com Mesalazina foi ineficaz. A adição de fibras a partir de aveia sobre o alimento conferiu apenas menor tenesmo. O emprego de probiótico (Lactobacillus sp. e Enterococcus sp.) trouxe basicamente menos flatulências. No seu antibiograma a única opção terapêutica era Amicacina, um antibiótico aminoglicosídeo. Somente um estudo utilizou este medicamento em cães com colite. O tratamento foi feito na dose de 10mg/Kg por 15 dias com monitoração da função renal. A resposta clínica foi notada após três dias de Amicacina (animal eliminou fezes normais pela primeira vez). Contudo, três dias após o seu término o quadro regrediu totalmente. Tinha-se conhecimento do índice de disbiose do paciente (exame de biologia molecular realizado em laboratório estadunidense). O resultado final do índice foi de + 4.1 (muito alto pois o ideal seria próximo a zero). Foi feito novo curso de 15 dias com Amicacina e um dia depois do término foi exibida piora do quadro onde em seguida foi realizado transplante de microbiota fecal. Sondagem retal após jejum alimentar e enema evacuante do paciente (sonda uretral n. 14 medindo 25cm). A quantidade foi de 60 gramas de fezes do doador (5 gramas/Kg). O doador escolhido foi triado com base em estudos internacionais e o índice de disbiose fecal dele era ideal diante da baixa expressão de E. coli e elevadíssima expressão de Clostridium hiranonis, ou seja, parâmetro desejado na microbiota. As fezes normalizaram em até 48 horas. Duas semanas depois foi feito outro transplante. Atualmente o animal segue assintomático há quase 3 meses, o novo índice teve resultado de – 2 (eubiose, ou seja, abaixo de zero, muito semelhante ao índice de sua doadora, inclusive na superexpressão de Clostridium hiranonis). O animal ganhou peso.
Discussão
A raça e a idade do paciente deste relato são coerentes com a literatura sobre colite granulomatosa (KEINER, et al, 2021; ROMANO et al, 2021; MANCHESTER et al, 2023). A triagem sérica e fecal utilizada para descartar doenças parasitárias foi coerente conforme sugerido pelos autores ROMANO e LALLO (2023) por conta de diferenciais causadores de diarreia como giardíase crônica e tricuríase (MOHAN et al, 2022). A colonoscopia foi o método de eleição para o diagnóstico por ser menos invasiva e permitir inspeção intraluminal (CORDELLA et al, 2021; ROMANO et al, 2021; COSTA e ROMANO, 2022). Quanto a não ter respondido totalmente a dieta hidrolisada nem ao tratamento usual de colites crônicas (Mesalazina, probiótico e fibras) isto também é uma constatação referida por autores sobre os animais com tal diagnóstico (DAVIES et al, 2004; ARGENTA et al, 2018) A Amicacina foi usada em no estudo anterior em cães com colite ulcerativa a partir do relato de MERINO-GUTIERREZ e colaboradores (2022) e ela tem sido um recurso nos casos arresponsivos às Quinolonas (MANCHESTER et al, 2021). Felizmente no presente relato a nefrotoxicidade não aconteceu.
Conforme colocado em estudos de CHAITMAN e GASCHEN (2021) e de PILLA e SUCHODOLSKI (2021) o índice de disbiose é o padrão-ouro para inferir eubiose ou disbiose pois apenas melhora clínica ou aumento sérico de folato são atualmente considerados inconsistentes. O transplante fecal empregado neste relato considerou a metodologia recentemente estabelecida quanto os critérios do doador e orientações da aplicação intrarretal (TORESSON et al, 2023). Percebeu- se que o aumento da expressão de Clostridium hiranonis foi determinante no paciente deste relato, isto é, bactéria considerada desejada e inibidora de outras bactérias consideradas patogênicas e toxigênicas, assim como referido pelos autores PILLA e SUCHODOLSKI (2021) e em outros estudos estrangeiros sobre o papel modulador deste microrganismo (GREEN et al, 2020; CHAITMAN e GASCHEN, 2021; TUNIYAZI et al, 2022).
Especificamente para controle de recidivas e manutenção de bom estado geral de Bulldog Francês com colite granulomatosa multirresistente ainda não se tinha relatado o papel do transplante de microbiota fecal da mesma forma que foi considerado para parvovirose (PEREIRA et al, 2018), clostridiose (GREEN et al, 2020), adjuvante contra a enteropatia crônica responsiva a imunossupressor (SUGITA et al, 2021; TORESSON et al, 2023). Seu valor está sobretudo pautado no objetivo de evitar o uso de antibióticos que são sabidamente indutores de disbiose e redutores da imunidade intestinal, potencialmente tóxicos e demandam custos e monitoração (STAVROULAKI et al, 2023).
Conclusão
Acreditamos que com base no avanço dos estudos acerca do microbioma de cães e gatos, especialmente nos últimos 5 anos, o conceito que antes parecia subjetivo sobre o potencial terapêutico do transplante fecal – total ou parcialmente indicado em enteropatias – pode ser encarado atualmente como uma realidade.
Anexos
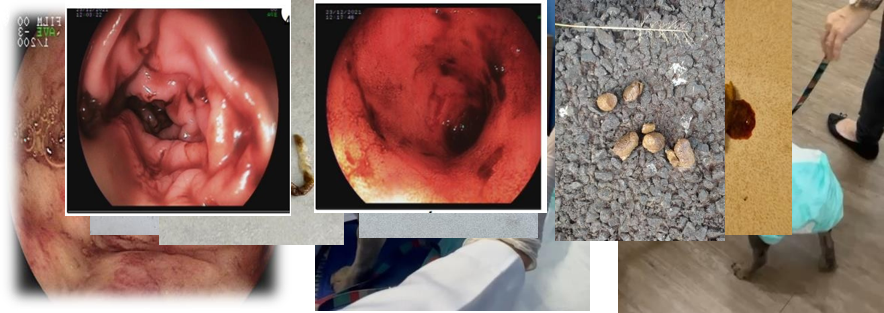
Imagens da Colonoscopia do paciente exibindo edema de paredes, sangramentos, estenose relativa da luz e hiperemia em ceco, íleo, cólon e reto (esquerda para direita) e depois imagens do paciente recebendo a infusão fecal via sondagem retal e ainda evolução do escore fecal deste.
Referências bibliográficas
ARGENTA, F., F.; DE SOUZA, S. O.; MEIRELLES, L. S.; SNEL, G. G. M.; LORENZO, C.; IENES-LIMA, J.; HORN, F.; DRIEMEIER, D.; PAVARINI, S. P. Histiocytic Ulcerative Colitis in an American Staffordshire Terrier. J. Comp. Pathol. v. 165. p. 40-44. 2018.
CASANOVA, M, M.; MARTIN, S.; MARCO, A.; SOLANO-GALLEGO, L. Detection of Leishmania spp. Infection by Immunohistochemistry in Archived Biopsy Samples from Dogs with Colitis in an Area Endemic for Leishmaniosis. J. Comp Pathol. v. 167. p. 12-17. 2019.
CHAITMAN, J.; GASCHEN, F. Fecal Microbiota Transplantations ind Dogs. Vet. Clin. North. Am. Small Animal Pract. v. 51, n. 1. p. 219-233. 2021.
CORDELLA, A.; STOCK, E.; VAN DE MAELE, I.; WILLEMS, A.; SAUNDERS, J. Use of Contrast-Enhanced Ultrasonography and Shear-Wave Elastography in the Diagnosis of Granulomatous Colitis in a French Bulldog. Vet. Sci. v. 8. n. 7. p. 133. 2021.
COSTA, P. R. S.; ROMANO, F. S. Doença Intestinal Inflamatória. SECAD- ARTMED. Editora Panamericana. v. 4. p. 09-36. 2022. DOI: 10.5935/978-65-5848- 612-1.C0004.
DAVIES, D., R.; O’HARA, A. J.; IRWIN, P., J.; GUILFORD, W. G. Successful management of histiocytic ulcerative colitis with enrofloxacin in two Boxer dogs. Aust. Vet J. V. 82. n. 01-02. p. 58-61. 2004.
GREEN, J. E.; DAVIS, J. A.; BERK, M.; HAIR, C.; LOUGHMAN, A.; CASTLE, D.; ATHAN, E.; NIERENBERG, A. A.; CRYAN, J. F.; JACKA, F.; MARX, W. Efficacy and safety of fecal microbiota transplantation for the treatment of diseases Other than Clostridium difficile infection: a systematic review and meta-analysis. Gut Microbes. v. 12, n.1 p. 01-25. 2020.
ISHII, P. E.; SUCHODOLSKI, J. S.; DUARTE, R.; PEREIRA, A. R. C.; LIDBURY, J. A.; STEINER, J. M.; GIARETTA, P. R. Detection of invasive Escherichia coli in dogs with granulomatous colitis using immunohistochemistry. J. Vet. Diagn. Invest. V. 34. N. 6. P. 990-994. 2022.
KATHER, S.; GRUTZNER, N.; KOOK, P. H.; DENGLER, F.; HEILMANN, R. M. Review of cobalamin status and disorders of cobalamin metabolismo in dogs. J. Vet. Internet Med. v. 34. n. 1. p. 13-28. 2020.
KEINER, M.; BALZHAUSER, L.; GUSSOW, A.; MORITZ, A. Granulomatous colitis in a French Bulldog puppy. Tierarztl Prax. Ausg. K. Kleintiere Heimtiere. v 49. n. 03. p. 212-218. 2021.
LECHOWSKI, R.; COTARD, J. P.; BOULOUIS, H. J.; KIETZMAN, M.; FARCA, A. M.; FONTAINE, J.; CANEY, S.; DUPREE, G. Proper use of quinolones for canine colitis ambulatory treatment: literature review and REQUEST guidelines. Pol. J. Vet Sci. v. 16. n. 01. p. 193-197. 2013.
MANCHESTER, A., C.; DOGAN, B.; GUO, Y.; SIMPSON, K. W. Escherichia coli-associated granulomatous colitis in dogs treated according to antimicrobial susceptibility profiling. J. Vet. Intern Med. v. 35. n. 01. p. 150-161. 2021.
MANCHESTER, A., C.; DOW, S.; CHOW, L.; GAGNE, J.; LAPPIN, M. R.; Efficacy of an elemental diet in achieving clinical remission in dogs with chronic enteropathy. J. Vet. Intern Med., v. 37, n. 6. P. 2322-2333. 2023.
MATSUMOTO, I.; NAKASHIMA, K.; MORITA, H.; KASAHARA, K.; KATAOKA, O.; UCHIDA, K. Escherichia coli-induced granulomatous colitis in a cat. JFMS Open Rep. v. 5. n. 01. 2055116919836537. 2019.
MERINO-GUTIERREZ, V.; PUIG, J.; FEO-BERNABE, L. Successful Treatment of 3 Dogs With Fluoroquinolone-Resistant Escherichia coli Associated Granulomatous Colitis. Top. Companion Anim. Med. v. 47. ELSEVIER. 100621. 2022.
MOHAN, S., B.; SANTHANAKUMAR, K.; NHAT, A., A. Endoscopic Recognition and Management of Trichuris vulpis Induced Colitis in Three Dogs: A Case Report. Iran J. Parasitol. v. 17. n. 02. p. 282-285. 2022.
NOLTE, A.; JUNGIINGER, J.; BAUM, B.; HEWICKER-TRAUTWEIN, M. Heterogeneity of macrophages in canine histiocytic ulcerative colitis. Innate Immun. v. 23. n. 02. p. 228-239. 2023.
PEREIRA, G.; GOMES, L. A.; SANTOS, I. S.; ALFIERI, A. F.; WEESE, J. S.; COSTA, M. C. Fecal microbiota transplantation in puppies with canine parvovirus infection. J. Vet. Intern. Med. v. 32. n. 02. p. 707-711. 2018.
PILLA, R.; SUCHODOLSKI, J. S. The Role of the Canine Gut Microbiome and Metabolome in Health and Gastrointestinal Disease. Front. Vet. Sci. v. 14. n. 6. p. 498. 2021.
ROMANO, F. S.; MAGNUSSON, J.; OLIVEIRA, I.; ZANINI M.; ANDRADE, G. Colite granulomatosa grave em cão da raça Bulldog Inglês (relato de caso) – Revista Cães e Gatos (Pet Food) n. 264 p. 52-54. 2021.
ROMANO, F.; LALLO, M. A. Efficacy of a single dose of nitazoxanide in dogs naturally infected with Giardia duodenalis. Res. Vet Sci. v. 159. p. 252-256. 2023.
STAVROULAKI, E. M.; SUCHODOLSKI, J., S.; XENOULIS, P., G. Effects of microbials on the gastrointestinal microbiota of dogs and cats. Vet. J. v. 291. doi: 10.1016/j.tvjl.2022.105929. 2023.
SUGITA, K.; SHIMA, A.; TAKAHASHI, K.; MATSUDA, Y.; MIYAJIMA, M.; HIROKAWA, M.; KONDO, H.; KIMURA, J.; ISHIHARA, G.; OHMORI, K. Successful outcome after a single endoscopic fecal microbiota transplantation in a Shiba dog with non-responsive enteropathy during the treatment with chlorambucil. J. Vet. Med. Sci. v. 83. n. 6. p. 984-989. 2021.
TORESSON, L.; SPILLMANN, T.; PILLA, R.; LUDVIGSSON, U.; HELLGREN, J.; OLMEDAL, G.; SUCHODOLSKI, J. S. Clinical Effects of Fecal Microbiota Transplantation as Adjunctive Therapy in Dogs with Chronic Enteropathies-A Retrospective Case Series of 41 Dogs. Vet. Sci. v. 10. n. 4. p. 271. 2023.
TUNIYAZI, M.; HU, X.; FU, Y.; ZHANG, N. Canine Fecal Microbiota Transplantation: Current Application and Possible Mechanisms. Vet. Sci. v. 9, n. 8. p. 396. 2022.
VAN KRUININGEN, H. J. Granulomatous colitis of boxer dogs: comparative aspects. Gastroenterology. v. 53. n. 01. p. 114-22. 1967.
YANG, Z.; WU, Z.; Gut Probiotics and Health of Dogs and Cats: Benefits, Applications, and Underlying Mechanisms. Microrganisms. v. 11. n. 10. p. 2452. 2023.





