

Orientador(a): Márcio Antonio Brunetto
Instituição: FMVZ USP
Trabalho Classificado na 9ª Edição (2023) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A obesidade é a principal doença nutricional que acomete seres humanos e animais de companhia. O tecido adiposo é considerado um órgão dinâmico, e o aumento dos depósitos corporais de gordura estão relacionados com alterações de determinadas funções biológicas, como o armazenamento de lipídeos, secreção de hormônios e armazenamento de vitaminas. O excesso desse tecido está relacionado com processos pró-inflamatórios e na indução de respostas imunológicas, o que caracteriza uma das principais diferenças entre animais obesos e em condição corporal ideal. Muitas das interações entre os sistemas metabólico e imunológico são orquestradas por uma rede complexa de mediadores solúveis de células imunes e adipócitos. Esses sistemas estão relacionados a transtornos de pele e pelos, na qual numerosos fatores nutricionais afetam a homeostase, a qualidade e o aspecto da pelagem desses animais. As reações adversas aos alimentos agrupam-se em dois tipos: as de origem imunológica e as de origem não imunológica. A dermatite trofoalérgica, ou alergia alimentar é definida como uma resposta anormal do sistema imune contra a ingestão de algum alimento ou aditivo alimentar. Este relato de caso identificou uma reação alérgica cutânea em um cão obeso após ingestão oral e gradual de β-glucano (0,01%) de diferentes fontes (Saccharomyces cerevisiae e Euglena gracilis). O animal apresentou reações de prurido, alopecia e eritema na região baixa do abdômen, após 15 dias de ingestão. A alergia foi cessada após a introdução de um alimento sem adição de β-glucanos. Supõe-se que esse cão possa ser propenso a esta reação como consequência de sua doença subjacente.
Introdução
Estima-se que entre 20 e 75% de todos os animais examinados na clínica veterinária apresentem enfermidades do sistema tegumentar como queixa principal ou como doença secundária (IHRKE, 1996; SCOTT et al., 2001). Dessas enfermidades, as alergias alimentares em cães representam cerca de 1,0% das dermatoses, além de ser uma doença pouco conhecida com relação a sua etiopatogenia, diagnóstico e tratamento (FERNANDES, 2005; SIMÕES et al., 2007). A reação de hipersensibilidade se inicia por mecanismos imunológicos, que pode ser mediada por anticorpos ou por células. Na maioria dos casos, o anticorpo responsável pela reação alérgica pertencente ao isotipo IgE. Na alergia não IgE mediada, o anticorpo pode pertencer ao isotipo IgG (JOHANSSON et al., 2004).
Segundo Walton (1977), a alergia alimentar pode resultar em sinais no trato gastrointestinal, na pele e no trato respiratório. De acordo com Hill (1999), os principais sinais clínicos manifestados nas alergias alimentares são o prurido e o eritema papular, principalmente em região auricular (80,0%), seguidos dos membros (61,0%) e região inguinal (53,0%) (ROSSER, 1990). Quanto a localização, pode ser localizado ou generalizado, além disso, escoriações, alopecia, crostas e piodermites superficiais são comuns (WALTON, 1967; AUGUST, 1985; MULLER et al.,1989). Vários autores afirmaram que o prurido é o sinal clínico mais importante daqueles relacionados às reações adversas aos alimentos (AUGUST, 1985; WHITE, 1986; REEDY & MILLER, 1989; BAKER, 1990; HARVEY, 1993; ROSSER, 1993; FADOK,1994; RHODES, 1995; ROUDEBUSH, 1995), no entanto, o mesmo não é necessariamente acompanhado de lesões cutâneas (REEDY & MILLER, 1989; BAKER, 1990; SCOTT, 1995).
A obesidade é atualmente a principal desordem nutricional dos animais de companhia (GERMAN et al., 2006). Em cães, alguns estudos avaliaram a frequência dessa afecção, o que varia de 20,0 a 40,0% (GOSSELLIN et al., 2007). Já Porsani et al. (2020) apontaram em um estudo realizado na cidade de São Paulo, a prevalência de obesos e em sobrepeso de 40,5%. Essa afecção é caracterizada pelo acúmulo excessivo de gordura proveniente do desequilíbrio entre a ingestão alimentar e o gasto energético (CARCIOFI, 2005). O indivíduo obeso apresenta estado constante de inflamação corporal, que frequentemente resulta em várias desordens sistêmicas (ODEGAARD & CHAWLA, 2011). O maior problema em animais com essa condição está relacionado às consequências resultantes, como dermatopatias, neoplasias, resistência insulínica, hiperlipidemia, complicações anestésicas, alteração na cinética de drogas, doenças ortopédicas, urinárias e reprodutivas (YUDKIN, 2003; GERMAN, 2006; GUIMARÃES & TUDURY, 2006; LAFLAMME, 2006; BRUNETTO et al., 2011).
No caso de dermatopatias, a pele do animal obeso pode ter sua função de barreia corporal comprometida por sofrer ressecamento, perda de fluído transepidérmico e eritema (LOFFLER et al., 2002). Enser e Avery (1984) demonstraram que a pele de ratos obesos é mecanicamente menos resistente quando comparada com a pele de ratos magros, decorrentes de falha na deposição de colágeno e aumento na área de superfície de pele nos indivíduos obesos.
Relato de caso
Foi recebido para triagem de higidez para um estudo clínico, um cão sem raça definida, fêmea, adulta, castrada, com idade de 6 anos, em escore de condição corporal 8/9 (LAFLAMME, 1997). A triagem visou garantir que o animal se apresentava hígido apesar de obeso, ou seja, com ausência de comorbidades. Para tal, procedeu-se a anamnese completa e exame físico e clinico do animal, por meio da qual foram verificados o histórico de uso de fármacos, doenças, moradia, alterações neurológicas, dieta oferecida, imunização, desverminação e controle ectoparasitário, bem como, frequências cardíaca e respiratória, hidratação, temperatura, palpação e auscultação dos sistemas digestório, urinário, reprodutor, nervoso, locomotor e tegumentar. Para a realização dos exames laboratoriais complementares, foi coletado sangue por punção de veia jugular para hemograma, bioquímica sérica (função renal e hepática, colesterol e triglicérides) e glicemia. Todos os parâmetros analisados encontravam-se dentro do intervalo de referência para a espécie e, assim, foi comprovada a higidez do animal para inclusão no estudo.
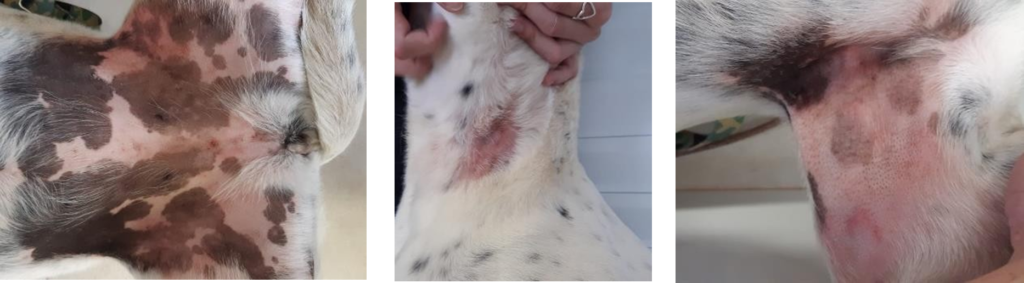
Em seguida foi disponibilizada uma dieta de padronização (Tabela 1) durante um mês. Neste período não foram relatadas alterações em escore e produção fecais, episódios de êmese, alteração na qualidade de pelo, prurido e alopecia. Tendo se adaptado ao alimento, foi dada continuidade no protocolo experimental e alterado o manejo alimentar do animal para dieta com adição de 0,01% de β- glucanos a base de parede celular de Saccharomyces cerevisiae. Após trinta dias de ingestão desta dieta o animal apresentou sinais clínicos de alopecia na região de pescoço, eritema e prurido nas axilas e região inguinal, além de queda de pelo generalizada (Figura 1). Portanto, foi efetuada nova consulta nutricional, na qual uma anamnese completa e exames físico e clínico foram realizados. Afim de melhorar a condição física do paciente, esse foi retirado do estudo e o alimento de padronização foi introduzido novamente. A alergia cessou em uma semana após a introdução desse alimento e o animal retornou ao estado saudável novamente. Para verificar se realmente o alimento com inclusão de β-glucanos estava envolvido com o surgimento dos sinais, iniciou-se o desafio da dieta com nova oferta do mesmo alimento experimental com 0,01% de β-glucanos de Saccharomyces cerevisiae. Após uma quinzena, o animal voltou a apresentar eritema em região inguinal e das axilas e retornou para o alimento de padronização novamente, onde objetivou-se retornar seu estado saudável. Em vista da melhor compreensão acerca do quadro alérgico do animal, foi instituída outra contraprova, com dieta contendo 0,01% de β-glucanos 1,3/1,6 originário de algas Euglena gracilis (Tabela 1) e mais uma vez o animal apresentou eritema de pele nas mesmas regiões em duas semanas, portanto um possível diagnóstico de alergia aos β-glucanos foi verificado.

Discussão
Uma vez que os β-glucanos são ingredientes que apresentam relação estrutura-atividade e devido à pouca ocorrência de outros relatos acerca desta condição na literatura, o presente relato buscou: compreender se o animal apresentava alergia aos β-glucanos de forma geral; a algum tipo específico de β- glucano ou; a algum ingrediente presente na formulação dos β-glucanos utilizados na extrusão.
Dos 36 animais incluídos neste estudo clínico, 12 foram randomizados em dietas com inclusão de ambos os β-glucanos (Saccharomyces cerevisiae e Euglena gracilis) e apenas um animal apresentou reação alérgica cutânea. Como foi garantido que o animal apenas ingeriu o alimento recomendado e tratava-se de alimento isonutriente, confirmou-se que os β-glucanos estavam relacionados a reação alérgica cutânea. Uma vez que existem poucos relatos de alergia a β- glucanos em animais saudáveis e com comorbidades na literatura, uma possível causa é a obesidade, pois o tecido adiposo estimula reações metabólicas inflamatórias e imunológicas. Os sistemas metabólico e imunológico são mediados por uma rede complexa de mediadores solúveis de células imunes e adipócitos (TILG & MOSCHEN, 2006).
Segundo Fantuzzi (2005), demonstrou-se que em seres humanos o tecido adiposo participa de forma ativa na inflamação e na imunidade, onde ocorre a produção e liberação de uma variedade de fatores pró-inflamatórios e anti- inflamatórios, sendo eles: leptina e adiponectina, bem como outras citocinas. Estudos clínicos e epidemiológicos têm demonstrado que tanto a incidência quanto a gravidade de várias doenças infecciosas são mais prevalentes em seres humanos obesos quando comparadas com pessoas em peso ideal (MILNER, 2012). Em humanos obesos existem evidencias que destacam a importância do estágio pró- inflamatório, e por consequência, as alterações da secreção de imunomoduladores, incluindo leptina, adiponectina e as citocinas pró-inflamatórias: TNF- α, IL-6 e IL-1 (FANTUZZI, 2005; KOERNER, 2005; TILG & MOSCHEN, 2006).
As reações alérgicas a alimentos são mediadas pela IgE (hipersensibilidade tipo l) que levam a sinais clínicos de hipersensibilidade. Os mastócitos são ativados pela IgE e liberam citocinas que causam reação de hipersensibilidade. O sintoma mais comum da alergia alimentar em cães é o prurido, reação encontrada no estudo. Em geral, o prurido está presente constantemente, mas a intensidade pode ser variável. O prurido pode ser generalizado ou limitado à face, orelhas, patas, axilas, região inguinal ou perineal (HILLIER & GRIFFIN, 2001).
Até o presente momento, há apenas um estudo com cães que relatou casos de reação alérgica a β-glucanos (AMARAL et al., 2022). O referido estudo foi composto por 18 cães, no qual foi observada reação alérgica cutânea ao β-glucano de Saccharomyces cerevisiae em 2 animais com doença inflamatória intestinal (DII) pré-existente, onde se relacionou sua doença subjacente à alergia ao β-glucano. Ressalta-se que no presente estudo, diferentemente do estudo supracitado, a reação alérgica ocorreu em um cão que não apresentava DII, além disso ocorreu após o consumo de β-glucanos de diferentes fontes, tanto de levedura (Saccharomyces cerevisiae) quanto de alga (Euglena gracilis).
Os β-glucanos derivados de levedura são purificados a partir da parede celular de levedura de Saccharomyces cerevisiae. Isso significa que o sistema imunológico pode reconhecer adequadamente seu padrão molecular para desencadear uma resposta imune conforme o esperado. Ademais, é conhecido que algumas proteínas da parede celular da levedura são conhecidas por desencadearem reações adversas cutâneas em pessoas com hipersensibilidade alimentar (CASTRO-SÁNCHEZ & MARTÍN-VILLA, 2013; VETVICKA et al., 2019).
De acordo com Heelan et al. (1991), a parede celular de Saccharomyces cerevisiae possui em sua composição uma proteína termicamente estável e glicoproteína solúvel gp200 com peso molecular de 200 kDA, que é imunogênica em humanos. Em um estudo in vitro, foi detectado um IgE anti-gp200 em 67% dos pacientes humanos com predisposição atópica, 63% dos pacientes com dermatite atópica leve e 86% dos pacientes com dermatite atópica grave (NENOFF et al., 2001) que inclui uma condição adicional onde essa glicoproteína pode produzir efeitos colaterais. Esses achados sugerem que a glicoproteína solúvel gp200 poderia estar associada a casos de reações alérgicas a β-glucanos derivados de levedura. No que se refere a β-glucanos derivados de Euglena gracilis, o possível mecanismo envolvido é desconhecido. De acordo com Turck et al. (2020), em 2018, a Comissão Europeia recebeu pedido para colocar o Euglena gracilis integral desidratada no mercado da União Europeia como novo alimento. Uma pesquisa bibliográfica realizada pelo requerente não revelou nenhum estudo ou relato de caso que levantasse preocupações potenciais sobre a alergenicidade de Euglena gracilis.
Conclusão
Conclui-se que pacientes obesos podem apresentar reação alérgica cutânea a β-glucanos, independentemente de ser derivado de Saccharomyces cerevisiae ou Euglena gracilis. Os mecanismos envolvidos permanecem incertos.
Referências bibliográficas
AMARAL, A. R. et al. Acute skin adverse effects of a yeast-β-glucan-based prebiotic intake in two dogs with inflammatory bowel disease. In: 26th Congress of the European Society of Veterinary and Comparative Nutrition, vol. 26, p. 179, 2022.
AUGUST, J. R. Dietary hypersensitivity in dogs: cutaneous manifestations, diagnosis and management. Compend Contin Educ, vol. 7, p. 469-77, 1985.
BAKER, E. Small animall allergy: a practical guide. Philadelphia : Lea & Febiger; Food allergy; p. 94-118, 1990.
BRUNETTO, M. A. et al. Correspondência entre obesidade e hiperlipidemia em cães. Ciência Rural, vol. 41, p. 266-271, 2011.
CARCIOFI, A. C. Obesidade e suas conseqüências metabólicas e inflamatórias em cães e gatos, vol. 10, 2005.
CASTRO-SÁNCHEZ, P., & MARTÍN-VILLA, J. M. Gut immune system and oral tolerance. British journal of nutrition, 109(S2), S3-S11, 2013.
EFSA Panel on Nutrition, Novel Foods and Food Allergens (NDA), Turck, D. et al. Safety of dried whole cell Euglena gracilis as a novel food pursuant to Regulation (EU) 2015/2283. EFSA Journal, 18(5), e06100, 2020.
ENSER, M.; AVERY, N. C. Mechanical and chemical properties of the skin and its 232 collagen from lean and obese-hyperglycaemic (ob/ob) mice. Diabetologia, vol. 27, n. 1, p. 233 44-9, 1984.
FADOK, V. A. Diagnosing and managing the food allergic dog. Compend Contin
Educ Pract Vet, vol. 16, p. 1541-44, 1994.
FANTUZZI, G. Adipose tissue, adipokines, and inflammation. Journal of Allergy and Clinical Immunology, vol. 115, p. 911–919, 2005.
FERNANDES, M. E. (104 p.) Alergia Alimentar em Cães. São Paulo, 2005. Dissertação (Mestrado em saúde pública) Faculdade de Saúde Pública da Universidade de São Paulo, São Paulo, SP, 2005.
GERMAN, A. J. The growing problem of obesity in dogs and cats. J. Nutr., vol. 136, Suppl n. 7, p. 1940-1946, 2006.
GUIMARÃES, A. L. N.; TUDURY, E. A. Etiologias, consequências e tratamentos de obesidades em cães e gatos – Revisão. Vet Notíc, vol. 12, n. 1, p. 29-41, 2006.
HARVEY, R. G. Food allergy and dietary intolerance in dogs: a report of 25 cases.
J Small Anim Pract,vol. 34, p. 175-79, 1993.
HEELAN, B. T. et al. Identification of a 200-kDa glycoprotein antigen of Saccharomyces cerevisiae. Immunology letters, 28(3), 181-185, 1991.
HILL P. Diagnosing cutaneous food alleregies in dogs and cats-some practical considerations. Practice, p. 287-94, 1999.
HILLIER, A.; GRIFFIN, C. A. The ACVD task force on canine atopic dermatitis (X): is there a relationship between canine atopic dermatitis and cutaneous adverse food reactions? Veterinary Immunology and Immunopathology, vol. 81, p. 227–231, 2001.
IHRKE, P.J. Bacterial infections of the skin. In: Diseases of the dog and cat. 2. Philadelphia: Saunders, p.72-79, 1990.
JOHANSSON, S. G. O et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Revew Committee of the World Allergy Organization. Allergy Clin Immunol., vol. 113, p. 832-36, 2004.
KOERNER, A. Adipocytokines: leptin – the classical, resistin – the controversical, adiponectin – the promising, and more to come. Best Practice & Research Clinical Endocrinology & Metabolism, vol. 19, p. 525–546, 2005.
LAFLAMME, D. Development and Validation of a Body Condition Score System for Dogs. Canine Practice, vol. 22, p. 10–15, 1997.
LAFLAMME, D. P. Understanding and managing obesity in dogs and cats. Vet. Clin. North Am.Small An. Pract., vol. 36, n.6, p. 1283-1295, 2006.
LÖFFLER H.; ARAMAKI J. U.; EFFENDY, I. The influence of body mass index on skin susceptibility to sodium lauryl sulphate. Skin Res. Technol., vol. 8, n. 1, p.19- 22, 2002.
MILNER, J. J., BECK, M. A. The impact of obesity on the immune response to infection. Proc Nutr Soc., vol. 71, p. 298–306, 2012.
MULLER, G. H.; KIRK, R. W.; SCOTT, D. W. Nutritional skin diseases in small animal In: Dermatology. Philadelphia: W. B.Saunders; p. 796-806, 1989.
NENOFF, P. et al. IgG and IgE immune response against the surface glycoprotein gp200 of Saccharomyces cerevisiae in patients with atopic dermatitis. Mycopathologia, 152, 15–21, 2001.
ODEGAARD, J. I.; CHAWLA, A. Alternative Macrophage Activation and Metabolism. Annu. Rev. Pathol., vol. 6, p. 275-297, 2011.
PORSANI, M. Y. H. et al. Prevalence of canine obesity in the city of São Paulo, Brazil. Scientific Reports, vol. 10, n. 1, p. 14082, 2020.
REEDY, L. M.; MILLER, J. R. Allergic skin diseases of dogs and cats. Philadelphia : W.B.Saunders: 1989. Food hypersentivity; p. 147-8.
RHODES, K. H. Food hypersensitivity intolerance. In: Annals of the Annual Waltham Symposium; Ohio, United States. Ohio; p. 12-6, 1995.
ROSSER, E. J. Diagnosis of food allergy in dogs. J Am Vet Med Assoc, vol. 203,
- 259-62, 1993.
ROSSER, E. J. In: Proceedings of the 6th th Annual General Meeting, of the American Academy of Veterinary Dermatology and American College of Veterinary Dermatology; San Francisco, United States. San Fancisco; p 47, 1990.
ROUDEBUSH, P. Adverse reactions to foods: allergies.In: Ettinger SJ, Feldman EC.Textbook of veterinary internal medicine. Philadelphia: W.B. Saunders; p. 258- 62, 1995.
SCOTT, D. W.; MILLER, W. H.; GRIFFIN, C. E.. Small animal dermatology . 5th Philadelphia : W.B. Saunders; Canine food hypersensitivity; p. 528-33, 1995.
SCOTT, D. W.; MILLER, W. H.; GRIFFIN, C.E. Small Animal Dermatology. 6.ed. Philadelphia: W.B. Saunders, 1528p, 2001.
SIMÕES, C.; BASTOS-FISCHER, C. D. Hipersensibilidade alimentar em cães.
Waltham News, p. 7, 2007.
TILG, H.; MOSCHEN, A. R. Adipocytokines: mediators linking adipose tissue, inflammation and immunity. Nature Reviews immunology, vol. 6, n. 10, p. 772783, 2006.
VETVICKA, V. et al. Beta glucan: supplement or drug? From laboratory to clinical trials. Molecules, 24(7), 1251, 2019.
WALTON, G. S. Allergic responses to ingested allergens: In Kirk RW, editor. Current veterinary therapy: small animal practice. Philadelphia : W. B. Saunders; p. 56., 1977.
WALTON, G. S. Skin responses in the dog and cat to ingested allergens. Vet Rec, vol. 81, p. 709-13, 1967.
WHITE, S. D. Food hypersensitivity in 30 dogs. J Am Vet Med Assoc, p. 188: 693- 98, 1986.
YUDKIN, J. S. Adipose tissue, insulin action and vascular disease: inflammatory signals. Int J of Obes, vol., n. 3, p. 25-28, 2003.





