

Orientador(a): Thiago Henrique Annibale Vendramini
Instituição: FMVZ USP
Trabalho classificado na 7ª Edição (2021) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A doença renal crônica consiste em uma das principais nefropatias caninas. Até o momento, estudos que analisaram o escore de condição corporal e o escore de massa muscular com o tempo de sobrevida de cães acometidos por esta enfermidade, constataram que a maior pontuação nessas escalas está relacionada diretamente com maior expectativa de vida dos pacientes. Entretanto, tais avaliações fizeram as análises de maneira isolada para estas variáveis, o que talvez pode gerar confusão na questão da causa e efeito dos resultados encontrados. Assim, o objetivo deste estudo foi realizar uma avaliação conjunta da correlação do escore de condição corporal e escore de massa muscular sobre a taxa de sobrevida de cães com doença renal crônica. Foram incluídos animais de ambos os sexos, diferentes raças e com idade superior a 1 ano, classificados em estágios 2, 3 ou 4 da doença renal crônica e sem outras afecções concomitantes. No total, 115 cães foram incluídos, os quais foram divididos em quatro grupos levando em consideração o escore de condição corporal e escore de massa muscular. Curvas de sobrevida foram calculadas de acordo com o método de Kaplan-Meier e o teste de log-rank foi utilizado para comparar as curvas. Valores de P≤0,05 foram considerados significativos. Ao final, os resultados encontrados demonstraram que cães com maior escore de massa muscular, independente do escore de condição corporal, tiveram maior taxa de sobrevida em comparação com aqueles com menor escore de massa muscular. Animais com maior escore de condição corporal, mas baixo escore de massa muscular podem apresentar sobrevida inferior ao de mesma musculatura e baixo escore de condição corporal. Por fim, os resultados demonstraram que a massa muscular está diretamente associada a maior expectativa de vida na doença renal crônica e que, ao contrário dos resultados publicados na literatura, o tecido adiposo pode ser um fator de prognóstico negativo, aspecto que contrapõe o que é defendido até o presente momento.
Introdução
A doença renal crônica (DRC) é definida como o conjunto de anormalidades estruturais ou funcionais dos rins que persistem por pelo menos 3 meses, detectadas por meio de sinais clínicos, urinálise, hematologia, análises bioquímicas e/ou ultrassonográficas (PELANDER et al., 2019). Apesar de ainda não se ter sua prevalência adequadamente estimada como em gatos (REYNOLDS & LEFEBVRE, 2013), os dados da Internacional Renal Interest Society (IRIS) de 2019 especularam que a DRC acometa de 0,5% a 1,0% dos cães (IRIS, 2019a).
Na medicina veterinária, estudos demonstraram que há correlação positiva entre ganho de peso, escore de condição corporal (ECC) e/ou escore de massa muscular (EMM) na taxa de sobrevida (TS) de cães e gatos com doenças crônicas ou em condições críticas, como linfoma (ROMANO et al., 2016), cardiopatias (SLUPE et al., 2008; INESON et al., 2019), pacientes hospitalizados (BRUNETTO et al., 2010; LIU et al., 2012; MOLINA et al., 2018) e a própria DRC (PARKER & FREEMAN, 2011; PEDRINELLI et al., 2020).
Os estudos de Parker & Freeman (2011) e Pedrinelli et al. (2020) destacaram que, ao se analisar a TS em função do ECC e EMM de maneira isolada, quanto maior a pontuação em qualquer uma dessas escalas, o que corresponde a maior quantidade de tecido adiposo e tecido muscular, respectivamente; maior a expectativa de vida dos pacientes.
Porém, esses achados constituem um paradoxo, na medida que o acúmulo excessivo de tecido adiposo é fator predisponente ao agravamento de doenças crônicas, principalmente através da síntese de mediadores inflamatórios (adipocinas ou adipocitocinas) (GERMAN et al., 2010; TVARIJONAVICIUTE et al., 2012; VENDRAMINI et al., 2020).
Os trabalhos na medicina veterinária que avaliaram a relação do ECC e/ou EMM na TS de pacientes com doenças crônicas estudaram essas variáveis de maneira independente. O acúmulo excessivo de tecido adiposo acompanha em partes a maior deposição de massa muscular, fenômeno descrito na literatura como “paradoxo da obesidade” (WEETH, 2016), o que pode implicar em confusão na relação de causa e efeito dos resultados. Portando, novos estudos que investiguem a correlação conjunta entre ECC e EMM com a TS nas doenças crônicas, com o propósito de esclarecer a real influência do tecido adiposo e do tecido muscular na fisiopatologia dessas afecções, são importantes.
Objetivos
O objetivo deste estudo foi fazer uma análise conjunta dos possíveis efeitos do escore de condição corporal e escore de massa muscular na taxa de sobrevida de cães diagnosticados com doença renal crônica.
Material e Métodos
Coleta de dados
Registros médicos de um hospital veterinário referência foram analisados de forma retrospectiva entre os anos de 2013 a 2018. As informações obtidas nos prontuários foram sinais clínicos, diagnóstico, ECC, EMM, estágio da DRC, e data do óbito. O tempo de sobrevida foi considerado como o período compreendido entre o diagnóstico da DRC até o óbito do paciente. Quando a data do óbito não estava presente no registro médico, foi realizado contato telefônico com o tutor do paciente. Animais ainda vivos durante a execução do estudo ou nos casos em que a data de óbito não foi possível de ser levantada foram retirados do estudo. As principais características dos pacientes inclusos na análise estão apresentadas no Quadro 1.
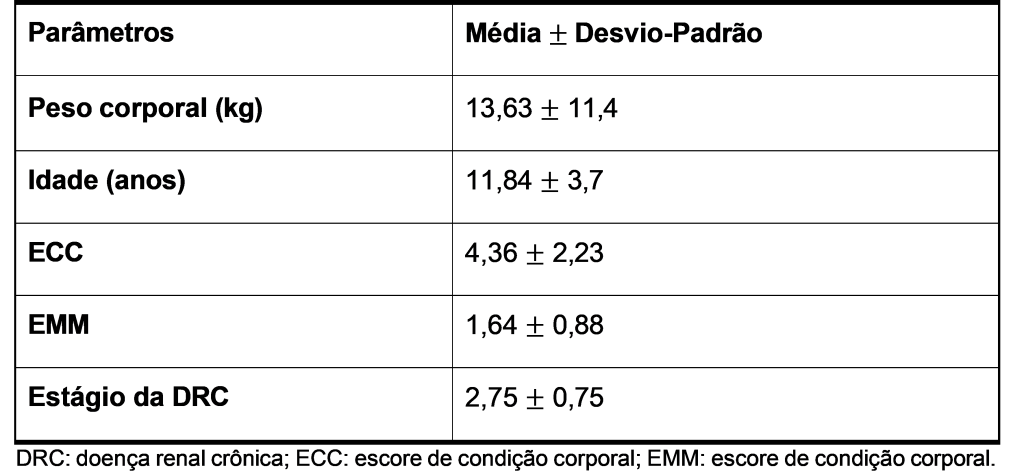
Animais
Os critérios de inclusão consistiram na seleção de cães de tutores, independente de sexo e raça, acima de um ano de idade, diagnosticados com DRC e sem outras doenças concomitantes. Cães que não retornaram após a primeira consulta, gestantes, lactantes, com registros médicos incompletos, que receberam tratamento prévio e/ou portadores de doenças concomitantes (incluindo doença renal congênita) foram excluídos do estudo. Ao final, 115 cães entre estágio 2 a 4 da DRC foram incluídos.
Exame Clínico
O exame clínico foi composto por anamnese completa para obtenção detalhada da história nutricional do paciente e do exame físico. Todos as etapas foram executadas por profissionais treinados de acordo com as diretrizes de Baldwin et al. (2010). Todos os pacientes foram pesados e tiveram o seu ECC classificado entre 1 a 9 de acordo com a escala de Laflamme (1997). O EMM foi classificado entre 0 a 3 de acordo com a escala de Michel (2011). O diagnóstico da DRC e classificação em estágio 2 ou superior, foi feito de acordo com as diretrizes indicadas pela IRIS (2019b).
Determinação dos grupos experimentais
Os animais foram classificados de acordo com o ECC e EMM: baixo ECC (1 a 4), alto ECC (6 a 9), baixo EMM (0 a 1) e alto EMM (2 a 3). Em seguida, distribuídos nos seguintes grupos para comparação da TS e elaboração das curvas de sobrevida: animais com baixo ECC e baixo EMM; baixo ECC e alto EMM; alto ECC e baixo EMM; e alto ECC e alto EMM.
Análise estatística
A análise estatística foi realizada por meio do software GraphPad Prism 6.0 (GraphPad Software, USA). As curvas de sobrevida foram calculadas de acordo com o método Kaplan-Meier e o teste log-rank (Mantel-Cox) foi usado para comparar as curvas. Valores de P≤0,05 foram considerados significativos.
Resultados e Discussão
De acordo com os resultados, animais com alto ECC e alto EMM tiveram maior TS (μ = 497,28 dias; P = 0,041) quando comparados aos animais de alto ECC e baixo EMM (μ = 180,14 dias) (Figura 1A); e cães com baixo ECC e alto EMM também tiveram maior TS (μ = 436,12 dias; P = 0,0235) quando comparados aos cães com baixo ECC e baixo EMM (μ =137,27 dias) (Figura 1B).
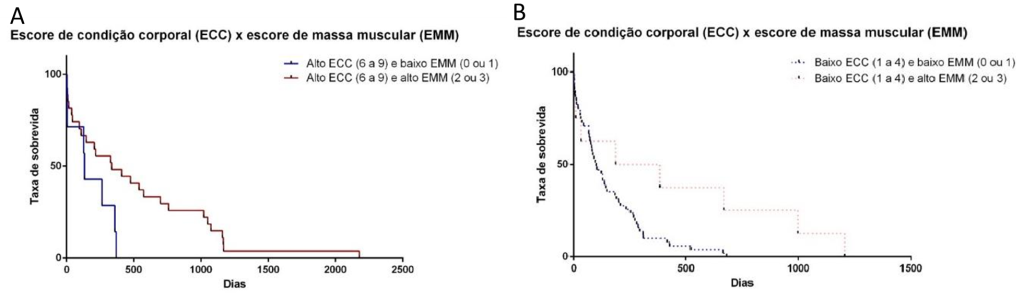
Os resultados demonstraram ainda, que não houve diferença entre animais de alto EMM e diferentes ECC (P = 0,8307), ou seja, animais em baixa ou pior condição corporal, mas que não perderam (ou que mantiveram) massa muscular, apresentaram sobrevida similar a pacientes com alto EMM e alto ECC.
Além de não ter influência positiva na TS, o ECC pode ser fator prognóstico negativo; pois quando comparados os grupos com diferentes ECC e baixo EMM estes não diferiram em nosso estudo (P = 0,7432) mas a condição obesa nesta enfermidade crônica pode ser agravante e ainda mais prejudicial.
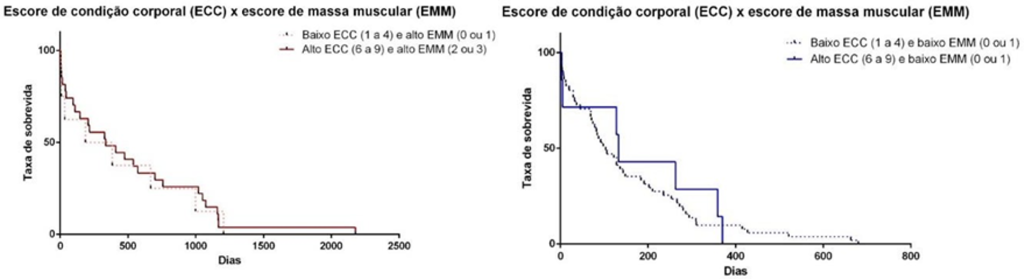
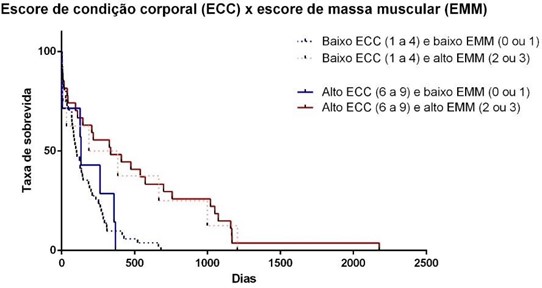
Os resultados encontrados podem ser melhor interpretados quando analisados de forma conjunta (Figura 3). Os dados aqui apresentados, diferem daqueles publicados na literatura veterinária até o momento, uma vez que a TS de cães com DRC foi associada de forma positiva em animais com maior ECC (JACOB et al., 2002; PARKER & FREEMAN, 2011; FREEMAN et al., 2016; e PEDRINELLI et al., 2020).
A hipótese principal que sustenta o possível efeito positivo do tecido adiposo e muscular na TS baseia-se no fato de que doenças crônicas resultam em quadro de inflamação crônica que, por sua vez, culmina na síndrome da caquexia (FREEMAN, 2012). Ou seja, cães com maior deposição de tecido muscular e adiposo seriam menos afetados por essa síndrome, em outras palavras, teriam perda de peso mais lenta.
Na DRC canina, especificamente, já se demonstrou que há maior expressão de RNA mensageiro das citocinas interleucina 1-alfa, interleucina 1-beta, interleucina 8, fator de necrose tumoral-beta, fator de necrose tumoral-alfa e 5- lipooxigensase, as quais, apesar de não terem seu metabolismo totalmente elucidado, aparentam estar associadas a ações degenerativas como fibrose, apoptose e transdiferenciação epitélio-mesenquimal de células renais (NENTWIG et al., 2016). Entretanto, o tecido adiposo também está envolvido na síntese de diversos mediadores inflamatórios, como interleucina 1, interleucina 6, interleucina 8 e fator de necrose tumoral-alfa; cuja concentração sérica pode estar aumentada em pacientes obesos (GERMAN et al., 2010; TVARIJONAVICIUTE et al., 2012; VENDRAMINI et al., 2020). Essas citocinas, por sua vez, podem intensificar a inflamação, bem como gerar ou agravar lesões observadas na DRC, o que explicaria os resultados obtidos neste estudo.
A hipótese do “possível efeito negativo” do ECC não foi levantada nos estudos anteriores e pode ser devido a forma de análise dos dados. Na maioria dos estudos, os pesquisadores analisaram os efeitos do ECC e do EMM na TS de maneira isolada. Desta forma, a interpretação dos resultados pode ter gerado confusão na relação de causa e efeito, uma vez que aqueles animais que estão em sobrepeso ou obesos também podem apresentar maior quantidade de tecido muscular (WEETH, 2016), mas isso não é regra. Sendo assim, este trabalho levanta esta possibilidade e para sua melhor comprovação, novas pesquisas devem ser realizadas em pacientes com DRC seguindo esta mesma linha de raciocínio.
Conclusão
Ao se avaliar de forma conjunta o escore de condição corporal e o escore de massa muscular, concluiu-se que a massa muscular normal ou com perdas leves estão associadas diretamente com a maior taxa de sobrevida de cães com doença renal crônica; e o escore de condição corporal pode ser considerado um pior preditor para se fazer esta associação.
Referências bibliográficas
Baldwin, K., Bartges, J., Buffington, T., Freeman, L. M., Grabow, M., Legred, J., Ostwald, D. (2010). AAHA Nutritional assessment guidelines for dogs and cats. Journal of the American Animal Hospital Association, 46, 285–296.
Brunetto, M. A., Gomes, M. O. S., Andre, M. R., Teshima, E., Gonçalves, K. N. V., Pereira, G. T., Ferraudo, A. S., Carciofi, A. C. (2010). Effect of nutritional support on hospital outcome in dogs and cats. Journal of Veterinary Emergency and Critical Care, 20(2), 224–231.
Freeman, L. M. (2011). Cachexia and Sarcopenia: Emerging Syndromes of Importance in Dogs and Cats. Journal of Veterinary Internal Medicine, 26(1), 3–17.
Freeman, L. M., Lachaud, M. P., Matthews, S., Rhodes, L., Zollers, B. (2016). Evaluation of Weight Loss Over Time in Cats with Chronic Kidney Disease. Journal of Veterinary Internal Medicine, 30(5), 1661–1666.
German, A. J., Ryan, V. H., German, A. C., Wood, I. S., Trayhurn, P. (2010). Obesity, its associated disorders and the role of inflammatory adipokines in companion animals. The Veterinary Journal, 185, 4–9.
Ineson, D. L., Freeman, L. M., Rush, J. E. (2019). Clinical and laboratory findings and survival time associated with cardiac cachexia in dogs with congestive heart failure. Journal of Veterinary Internal Medicine, 33(5), 1902-1908.
IRIS Staging of CKD (Updated 2019b). IRIS (International Renal Interest Society). Disponível em: < http://www.iris- kidney.com/pdf/IRIS_Staging_of_CKD_modified_2019.pdf> Acesso em: 17 de fevereiro de 2021.
Jacob, F., Polzin, D. J., Osborne, C. A., Allen, T. A., Kirk, C. A., Neaton, J. D., Lekcharoensuk, C., Swanson, L. L. (2002). Clinical evaluation of dietary modification for treatment of spontaneous chronic renal failure in dogs. Journal of the American Veterinary Medical Association, 220(8), 1163–1170.
Laflamme, D. P. (1997). Development and validation of a body condition score system for dogs: a clinical tool. Canine Practice, Santa Barbara, 22(3), 10-15.
Liu, D. T., Brown, D. C., Silverstein, D. C. (2012). Early nutritional support is associated with decreased length of hospitalization in dogs with septic peritonitis: A retrospective study of 45 cases (2000-2009). Journal of Veterinary Emergency and Critical Care, 22(4), 453–459.
Michel, K. E, Anderson, W., Cupp, C., Laflamme, D. P. (2011). Correlation of feline muscle mass score with body composition determined by dual-energy x-ray absorptiometry. British Journal of Nutrition, 106, 57-59.
Molina, J., Hervera, M., Manzanilla, E. G., Torrente, C., Villaverde, C. (2018) Evaluation of the prevalence and risk factors for undernutrition in hospitalized dogs. Frontiers in Veterinary Science, 5, 1‐8.
Nentwig, A., Schweighauser, A., Maissen-Villiger, C., Bruckmaier, R. M., Zurbriggen, A., van Dorland, H. A., Francey, T. (2016). Assessment of the expression of biomarkers of uremic inflammation in dogs with renal disease. American Journal of Veterinary Research, 77(2), 218–224
Parker, V. J. & Freeman, L. M. (2011). Association between Body Condition and Survival in Dogs with Acquired Chronic Kidney Disease. Journal of Veterinary Internal Medicine, 25(6), 1306–1311.
Pedrinelli, V., Lima, D. M., Duarte, C. N., Teixeira, F. A., Porsani, M., Zarif, C., Amaral, A. R., Vendramini, T. H. A., Kogika, M. M., Brunetto, M. A. (2020). Nutritional and laboratory parameters affect the survival of dogs with chronic kidney disease. PLoS One, 15(6), e0234712.
Pelander, L., Häggström, J., Larsson, A., Syme, H., Elliott, J., Heiene, R., Ljungvall
- (2019). Comparison of the diagnostic value of symmetric dimethylarginine, cystatin C, and creatinine for detection of decreased glomerular filtration rate in dogs. Journal of Veterinary Internal Medicine, 33, 630-639.
Reynolds, B. S. & Lefebvre, H. P. (2013). Feline CKD: Pathophysiology and risk factors–what do we know? Journal of Feline Medicine and Surgery, 15(1), 3-14.
Risk factors in dogs and cats for development of chronic kidney disease (Updated 2019a). IRIS (International Renal Interest Society). Disponível em: <http://www.iris- kidney.com/education/risk_factors.html> Acesso em: 17 de fevereiro de 2021.
Romano, F. R., Heinze, C. R., Barber, L. G., Mason, J. B., Freeman, L. M. (2016). Association between Body Condition Score and Cancer Prognosis in Dogs with Lymphoma and Osteosarcoma. Journal of Veterinary Internal Medicine, 30(4), 1179–1186.
Slupe, J. L., Freeman, L. M., Rush, J. E. (2008). Association of Body Weight and Body Condition with Survival in Dogs with Heart Failure. Journal of Veterinary Internal Medicine, 22(3), 561–565.
Tvarijonaviciute, A., Ceron, J. J., Holden, S. L., Biourge, V., Morris, P. J., German,
- J. (2012). Effect of weight loss in obese dogs on a range of renal biomarkers. Journal of Veterinary Internal medicine, 193, 570-572.
Vendramini, T. H. A., Macedo, H. T., Amaral, A. R., Rentas, M. F., Macegoza, M. V., Zafalon, R. V. A., Pedrinelli, V., Mesquita, L. G., Balieiro J. C. C., Pfrimer, K., Pedreira, R. S., Nowosh, V., Pontieri, C. F. F., Massoco, C. O., Brunetto, M. A. (2020). Gene expression of the immunoinflammatory and immunological status of obese dogs before and after weight loss. PLoS One, 15(9), e0238638
Weeth, L. P. (2016). Other Risks/Possible Benefits of Obesity. Veterinary Clinics of North America: Small Animal Practice, 46(5), 843–853.





