

Orientador(a): Aulus Carciofi
Instituição: FCAV UNESP
Trabalho classificado na 8ª Edição (2022) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
Duas proporções de amido e proteína (alto amido [AA]: 25% amido e 36% proteína; alta proteína [AP]: 15% amido e 53% proteína, com base na matéria seca) e dois teores de umidade (5%, ração seca[RS]; 80%, ração úmida[RU]) foram comparados em um arranjo fatorial 2 x 2 totalizando 4 dietas. Cada dieta foi avaliada em nove gatos, com oito dias de coleta total de urina e fezes. Os resultados foram submetidos à análise de variância considerando os efeitos da relação amido/proteína, teor de umidade e suas interações (P<0,05). Embora a ingestão de cálcio tenha sido maior para alimentos secos e AA, sua concentração urinária e excreção renal foram maiores para dietas secas e AP (P<0,05). A concentração de oxalato na urina foi 60% maior para os gatos alimentados com as formulações AA (P<0,05). A supersaturação relativa (SSR) da urina para oxalato de cálcio foi 135% maior para alimentos secos e formulações AA (P<0,01), enquanto para estruvita a SSR foi menor em alimentos úmidos e, entre as dietas secas menor para AA do que para a formulação AP (P<0,01). O consumo de alimentos com mais de 80% de umidade levou a maior ingestão de água total, aumento de 64% no volume urinário, redução da densidade urinária (média de 1.050±0,01 para RS; média de 1.020±0,01 para RU) e redução de 40% na SSR da urina para oxalato de cálcio e 22% para estruvita (P<0,05). Consumo de formulação com alta proporção proteína/amido aumentou a ingestão hídrica total, o volume urinário e, apensar de ter induzido maior excreção renal de Ca reduziu a SSR da urina para oxalato de cálcio (P<0,05).
Palavras-chave: citrato, cálculo, urolitíase, alimentos úmidos.
Introdução
A urolitíase é processo complexo de biomineralização que se inicia com a formação de microcristais e termina com a formação de urólitos maduros no trato urinário (OSBORNE et al., 2010). Apesar de mudanças na prevalência ao longo dos anos, o oxalato de cálcio e o fosfato de amônio magnesiano (estruvita) são os principais urólitos que acometem os gatos (FORRESTER; ROUDEBUSH, 2007). Estimativas variam de 13% a 18% da população felina acometida pela doença do trato urinário inferior dos felinos (OSBORNE et al., 2009; MENDOZA- LÓPEZ et al., 2019; KOPECNY et al., 2021).
A nutrição adequada para gatos formadores de urólitos é considerada essencial para se evitar intercorrências e necessidade de procedimentos invasivos para remoção dos cálculos (MARKWELL et al., 1998). A dieta e o metabolismo influenciam a excreção renal de substâncias calculogênicas, o que juntamente com o balanço hídrico e consequente o volume urinário determinarão a concentração na urina das substâncias que podem promover ou impedir a mineralização (HOSTUTLER et al., 2005; DIBARTOLA, 2012). O pH urinário é outro fator preponderante, estritamente controlado pela composição macromineral da dieta, que determina a força de agregação e biomineralização dos cristais na urina (ROBERTSON et al., 2002). Entretanto, o uso apenas do pH urinário não é adequado para se predizer a formação de urólitos, sendo necessário o cálculo da supersaturação relativa da urina (SSR) (ROBERTSON et al., 2002; HOUSTON et al., 2011).
Dietas extrusadas secas, muito populares entre os donos de gatos, induzem menor ingestão de água através dos alimentos, pois geralmente têm menos de 10% de umidade. A maioria dos estudos publicados descreve que gatos, nesta situação, não realizam compensação completa com maior ingestão de água de bebida, tendo assim baixa ingestão total de água e, consequentemente, menor volume urinário e aumento da densidade urinária em quando recebem rações secas em comparação com a ingestão de alimentos úmidos (ANDERSON, 1982; ZORAN, 2002). No entanto, o impacto na SSR para oxalato de cálcio e estruvita da diluição promovida pela ingestão de alimentos úmidos ainda não é claro (BUCKEY et al., 2011).
As dietas extrusadas secas também são relativamente ricas em amido e baixas em proteína em comparação com presas, a dieta ancestral dos felinos (DIERENFELD et al., 2002). O amido favorece a extrusão (BALLER et al., 2018), é uma boa fonte de energia metabolizável, com alta digestibilidade para gatos e não induz alterações representativas nas respostas pós-prandiais de glicose e insulina, especialmente em indivíduos não obesos (DE OLIVEIRA, 2008). No entanto, dietas ricas em amido e moderadas em proteína podem resultar em baixa produção de urina, já que a proteína é reconhecida por induzir a excreção renal de água e a diurese em gatos (HASHIMOTO et al., 1995). Maior ingestão de amido também resulta em maior disponibilidade metabólica de glicose, um precursor do oxalato (BEHNAM et al. 2006). Estudos demonstraram maior concentração urinária de oxalato, menor volume urinário e maior SSR para oxalato de cálcio em gatos alimentados com formulações com elevado amido (DIJCKER et al. 2011; MENDONÇA et al., 2018). Estas informações, no entanto, são baseadas em estudos com dietas secas e nenhum estudo sobre o efeito do amido foi encontrado em alimentos úmidos.
Foram hipóteses desse estudo que a ingestão de alimentos úmidos induzirá maior ingestão total de água e volume urinário, reduzindo a densidade urinária e SSR para oxalato de cálcio e estruvita. A menor ingestão de amido, resultante de elevada ingestão de proteína, resultará em menor síntese endógena e excreção renal de oxalato, maior volume urinário e menor SSR para oxalato de cálcio. Para isso, esse estudo avaliou o balanço hídrico, características da urina, excreção renal de oxalato, cálcio e citrato, e a SSR urinária para oxalato de cálcio e estruvita de gatos alimentados com alimentos secos ou úmidos, com duas proporções amido:proteína.
Materiais e Métodos
Foram utilizados 36 gatos hígidos, com idade de 4,1±1,2 anos, e escore de condição corporal 5,3±0,6 (LAFLAMME, 1997). O delineamento empregado foi o em blocos inteiramente casualizados, com 3 blocos de 12 gatos, 3 gatos por dieta em cada bloco, totalizando 9 gatos (repetições) por alimento. Os gatos receberam as dietas por 18 dias, sendo 10 dias para adaptação às dietas 8 dias para coleta total de fezes e urina. No período de coleta gatos permaneceram alojados individualmente em gaiolas, sendo registrados o consumo de alimentos e de água.
Dietas Experimentais
Os tratamentos foram organizados em esquema fatorial 2 x 2, com duas relações amido/proteína (Alto Amido: 25% amido e 36% proteína bruta [PB], na matéria seca; Alta Proteína: 15% amido e 53% PB) e dois teores de umidade (5% [ração seca extrusada]; 80% umidade [ração úmida]), totalizando quatro tratamentos experimentais. As dietas foram formuladas para apresentarem excesso de base semelhante e induzir pH urinário próximo a 6.2 (JEREMIAS, 2013).
Balanço hídrico
Durante oito dias consecutivos o balanço hídrico foi determinado computando-se a ingestão de água no bebedouro (estabelecida descontando-se a perda de água por evaporação), a ingestão de água pela alimentação, a água metabólica gerada, a excreção de água pelas fezes e pela urina e as perdas insensíveis (CARCIOFI et al., 2005).
Parâmetros urinários e supersaturação relativa para oxalato de cálcio e estruvita
Nos primeiros cinco dias a urina foi coletada com 100 mg de timol. A urina de 24 horas foi homogeneizada e teve aferido seu volume, densidade e pH. Foram utilizados kits comerciais para análise de cálcio, fósforo, magnésio ácido úrico, cloreto e ureia (Labtest S.A, Lagoa Santa, Brasil). Sódio e potássio obtidos por eletrodos íon-seletivos (Roche Diagnostics, 9180, EUA). Enxofre foi analisado pelo método turbidimétrico (AOAC, 2010) em espectrofotômetro. Citrato e oxalato analisados por determinação enzimática e colorimétrica (LTA, Bussero, Itália).
Nos últimos três dias a urina foi coletada com 1 mL de H2SO4 1N para mensuração de amônia urinária, segundo método de Kjedhal (AOAC, 2010). Com base nos resultados, a SSR da urina para oxalato de cálcio foi calculada usando o software EQUIL-93 (Department of Biochemistry and Molecular Biology, University of Florida, USA) e SSR para oxalato de cálcio e estruvita usando o software SUPERSAT (SSR calculator for pets, Mars, Incorporated and its Affiliates, versão atualizada do programa desenvolvido por Robertson, 1969).
Análise estatística
Os resultados foram avaliados dentro de esquema fatorial 2 (relações amido:proteína) x 2 (teores de umidade), totalizando 4 tratamentos experimentais, seguindo delineamento em blocos ao acaso. Dados foram submetidos à análise de variância, considerando-se os efeitos relação amido:protéina, teor de umidade e suas interações. Quando interações foram detectadas no teste F, médias foram comparadas pelo teste de Tukey (P<0,05).
Resultados
O pH urinário foi semelhante entre as dietas (P>0,05), com valor médio de 6.13±0,06 A densidade da urina foi maior para alimentos secos (RS:1.051±0,001 RU:1.020±0,002; P<0,01) e, dentre os secos maior para AP em comparação a AA (P<0,05). A ingestão total de água e a produção de urina foram maiores nas rações úmidas (P<0,01) e, dentre as rações úmidas maior para AP em reação a AA (P<0,05; Tabela 1). Apesar da ingestão de Ca ter sido maior para alimentos alto amido e secos, a concentração urinária e a excreção renal de cálcio foram maiores para alimentos secos e AP (P<0,01; Tabela 2). Pelo software Equil, gatos alimentados com alimentos secos e com formulações com AA apresentaram maior SSR da urina para oxalato de cálcio (P<0,01). Pelo software Supersat, foi observado maior SSR para oxalato de cálcio para gatos alimentados com rações secas (P<0,01) sem efeito da relação amido:proteína (P>0,05). Interação foi observada quanto a SSR para estruvita, maior em gatos alimentados com a ração seca AP, intermediária para seca AA e menor para ambas as formulações úmidas (P<0,05). A concentração de oxalato na urina foi maior na urina dos animais alimentados com as formulações AA (P<0,01). A excreção renal de oxalato, por outro lado, foi maior para ração úmida (P<0,01).
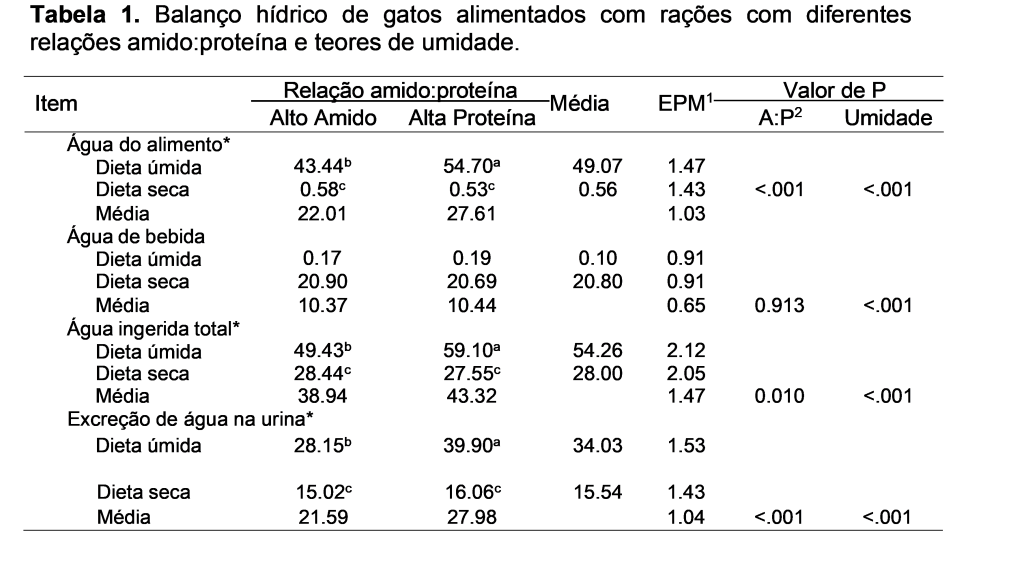

Discussão e Conclusões
A formulação das rações atingiu aos objetivos propostos, as dietas secas e úmidas tiveram teores de proteína e amido próximos aos esperados e induziram nos gatos produção de urina com pH semelhante, próximo a 6.2. Isto é importante devido ao destacado efeito do pH na SSR da urina para estruvita e mesmo oxalato de cálcio (JEREMIAS, 2013). Desta forma, o efeito da relação amido:proteína e da umidade do alimento pôde ser avaliado corretamente.
Como verificado por outros autores, gatos alimentados com alimento seco apresentaram menor ingestão total de água, menor volume de urina e maior densidade urinária (BUCKEY et al., 2011). A diurese induzida pelo consumo de alimento úmido foi relevante, com aumento do volume urinário em 64% e redução destacada da densidade urinaria (KNIGHT, 2007). Em conjunto, estes explicam as menores concentrações relativas de substâncias calculogênicas, com importante redução da SSR para oxalato de cálcio, que se reduziu em 40% em comparação ao alimento seco e de estruvita, que se reduziu em 22%.
Elevado consumo de proteína, com menor ingestão proporcional de amido também foi efetiva em elevar o volume de urina, que foi maior em relação às formulações com alto amido. Esta maior diurese após elevada ingestão de proteína é consequência ao efeito osmótico da ureia, elevando a tonicidade no filtrado glomerular (LEKCHAROENSUK et al., 2001). Assim, não há redução, mas aumento da densidade urinária, como verificado no presente estudo. Foi notado, também, relação entre maior consumo proteico e maior calciúria nos gatos, o que tornava incerto, especialmente quanto avaliado em conjunto com a maior densidade urinária, o feito da diurese induzida por consumo proteico na SSR da urina. No entanto, os resultados obtidos de SSR para oxalato de cálcio confirmaram que apesar de mais cálcio ser excretado, o menor oxalato e a diluição da urina reduziram a SSR para oxalato de cálcio, justificando esta abordagem alimentar no controle deste urólito.
Elevado consumo de amido resultou, por outro lado reduziu a diurese com elevação de 60% da concentração de oxalato, com consequente elevação da SSR da urina para oxalato de cálcio (MENDONÇA et al, 2018). O efeito do amido, no entanto, foi oposto para a SSR de estruvita, pois gatos alimentados com rações secas alta proteína tiveram elevação de 83% na SSR deste urólito, o que necessitaria de mais estudos.
Referências bibliográficas
ANDERSON R.S Water balance in the dog and cat. Journal of Small Animal Practice, v.23, p. 588-598, 1982.
BALLER M.A, PACHECO P.D, PERES F.M, MONTI M, CARCIOFI A.C. The effects of inbarrel moisture on extrusion parameters, kibble macrostructure, starch gelatinization, and palatability of a cat food. Animal feed science and technology. v.246, p.82-90, 2018.
BEHNAM J.T, WILLIAMS E.L, BRINK S, RUMSBY G, DANPURE C.J Reconstruction of human hepatocyte glyoxylate metabolic pathways in stably transformed Chinesehamster ovary cells. Biochemical Journal, v.394, p. 409– 416, 2006.
BRESLAU N.A, BRINKLEY L, HILL K.D. Relationship of animal protein- rich diet to kidney stone formation and calcium metabolism. J Clin Endocrinol Metab, v.66, p.140-146, 1988.
BUCKLEY, C., HAWTHORNE, A., COLYER, A., & STEVENSON, A. Effect of dietary water Ingestão on urinary output, specific gravity and relative supersaturation for calcium oxalate and struvite in the cat. British Journal of Nutrition, v.106, p.28-130, 2011. doi:10.1017/S0007114511001875
CARCIOFI A.C, BAZOLLI R.S, ZANNI A, KIHARA L.R.L, PRADA F. Influence of water content and the digestibility of pet foods on the water balance of cats. Brazilian Journal Veterinary Research Animal Science, v.42, p.429- 434, 2005.
DIBARTOLA S.P. Applied physiology. In: DiBartola, SP. Fluid, Electrolyte, and Acid-Base Disorders In: Small Animal Practice, p.7-20, 2012.
DIERENFELD E.S, ALCORN H.L, JACOBSEN K.L. Nutrient composition of wholevertebrate prey (excluding fish). National Agricultural Library, p.65, 2002.
DE OLIVEIRA, L.D., CARCIOFI, A.C., OLIVEIRA, M.C.C., VASCONCELLOS, R.S., BAZOLLI, R.S., PEREIRA, G.T., PRADA, F Effects of six carbohydrate sources on diet digestibility and postprandial glucose and insulin responses in cats. Journal of Animal Science, v.86, p.2237–2246, 2008.
DIJCKER, J.C., PLANTINGA, E.A., VAN, B.A.A.L, J., HENDRIKS, W.H. Influence ofnutrition on feline calcium oxalate urolithiasis with emphasis on endogenous oxalate synthesis. Nutrition Research Reviews, v.24, n.1, p.96– 110, 2011.
FORRESTER, S.D.; ROUDEBUSH, P. Evidence-based management of feline.lower urinary tract disease. Veterinary Clinics Small Animal Practice, West Sussex, v.37, n3, p.533–558, 2007.
HASHIMOTO, M., FUNABA, M., Abe, M., OHSHIMA, S. Dietary protein levels affect water Ingestão and urinary excretion of magnesium and phosphorus in laboratory cats. Experimental animals v.35, p.29, 1995.
HOUSTON D.M, WEESE H.E, EVASON M.D, BIOURGE V, VAN HOEK I. A diet with a struvite relative supersaturation less than 1 is effective in dissolving struvite stones invivo. The British Journal of Nutrition v.106, p. 90-92, 2011.
HOSTUTLER R.A, CHEW D.J, DIBARTOLA S.P. Recent concepts in feline lower urinary tract disease. Veterinary Clinics of North America: Small Animal Practice v.35, p.147–170, 2005.
JEREMIAS, J. T. NOGUEIRA, S.P, BRUNETTO, M.A, PEREIRA, G.T, LOUREIRO BA, FERREIRA, C.S, GOMES, M.O.S, CARCIOFI, A.C. Predictive formulas for food base excess and urine pH estimations of cats. Animal Feed Science and Technology v.182, p.82–92, 2013.
KNIGHT, J., HOLMES, R. P., & ASSIMOS, D. G. Intestinal and renal handling of oxalate loads in normal individuals and stone formers. Urological Research, v.35, n.3, p.111–117, 2007.https://doi.org/10.1007/s00240-007-0090- 8
KOPECNY, L., PALM, C.A., SEGEV, G., LARSEN, J.A., & WESTROPP, Urolithiasis in cats: Evaluation of trends in urolith composition and risk factors (2005‐2018). Journal of Veterinary Internal Medicine v.2, p. 145-51, 2021.
LAFLAMME, D.P. Development and validation of a body condition score system for cats: A clinical tool. Feline Practice v.25, p.13-17, 1997.
LEKCHAROENSUK C, OSBORNE C.A, LULICH J.P, PUSOONTHORNTHUM R, KIRK, C.A, ULRICH L.K, KOEHLER L.A, CARPENTER K.A, SWANSON L.L. Association between dietary factors and calcium oxalate and magnesium ammonium phosphate urolithiasis in cats. J Am Vet Med Assoc, v.9, p.1228-37, 2001. doi: 10.2460/javma.2001.219.1228.
LULICH, J.P.; OSBRONE, C.A.; BARTGES, J.W.; LEKCHAROENSUK, C. Distúrbios do trato inferior dos caninos. In: ETTINGER, S.J.; FELDMAN, E.C.
Tratado de medicina interna veterinária. 5 ed. v. 2. p. 1847-1872, 2004.
MARKWELL P.J, BUFFINGTON C.T, SMITH B.H. The effect of diet on lower urinary tractdiseases in cats. The Journal of Nutrition v.128, p.2753-2757 1998.
MENDONÇA, F.S, PEDREIRA, R.S, LOUREIRO, B.A, PUTAROV, T.C, MONTI, M, CARCIOFI, A.C. Hydroxyproline and starch consumption and urinary supersaturation with calcium oxalate in cats. Animal feed science and technology v.246, p.72-81, 2018.
MENDOZA-LÓPEZ, C.L, DEL-ANGEL-CARAZA, J, AKÉ-CHIÑAS, M.A, QUIJANO- HERNÁNDEZ, I.A,BARBOSA-MIRELES, M.A Epidemiology of feline urolithiasis in Mexico (2006–2017). Journal of Feline Medicine and Surgery Open Reports. 2019.doi:10.1177/2055116919885699
OSBORNE C.A, LULICH J.P, KRUGER J.M, et al. Analysis of451,891 canine uroliths, feline uroliths, and feline urethral plugs from 1981 to 2007: perspectives from the Minnesota Urolith Center. Vet Clin North Am Small Anim Pract, v.39, p. 183–197, 2009.
OSBORNE, C.A., LULICH, J.P., ULRICH, L.K Canine Urolithiasis: Definitions, Pathophysiology and Clinical Manifestations. In: Hand, M.S., THATCHER, C.D., REMILLARD, R.L., ROUDEBUSH, P., NOVOTNY, B.J. Small Animal Clinical Nutrition, v.5, p. 813-832, 2010.
PABLACK, N, BURMEIER, H, BRENTEN, T, ZENTEK, J. Relevance of the dietary protein concentration and quality as risk factors for the formation of calcium oxalate stones incats. Journal of Nutritional Science v.3: p.51, 2014. ROTILY M, LEONETTI F, LOVANNA C. Effects of low animal protein or high fiber diets on urina composition in calcium nephrolithiasis. Kidney Int, v.57, p.115-123, 2000.
ROBERTSON, W.G, JONES, J.S, HEATON, M.A, STEVENSON, A.E, MARKWELL, P.J Predicting the crystallization potential of urina from cats and dogs with respect to calcium oxalate and magnesium ammonium phosphate (struvite). The Journal of nutrition, v.132, p.1637-1641, 2002.
ZORAN, D.L The carnivore connection to nutrition in cats. Journal of theAmerican Veterinary Medical Association, v.221, p.1559–1567, 2002.





