

Orientador(a): Mariana Ferreira de Almeida
Instituição: UNOPAR
Trabalho classificado na 7ª Edição (2021) do Prêmio de Pesquisa PremieRpet®.
Índice
Resumo
A doença inflamatória intestinal crônica é uma doença pouco compreendida e acredita-se que se caracterize por uma enteropatia imunomediada. O presente estudo tem como objetivo relatar o caso de um paciente canino, macho, não castrado, Yorkshire Terrier, de sete anos, com 5,2 kg de peso corporal, com doença inflamatória intestinal com perda de proteína. O tratamento adotado consistiu exclusivamente em modificações dietéticas em duas etapas. A primeira etapa foi a instituição de duas dietas de exclusão compostos por ingredientes inéditos ao paciente, onde cada dieta foi fornecida durante quatro semanas, totalizando oito semanas de exclusão alimentar e a segunda etapa consistiu no desafio a diferentes alimentos, de forma individualizada e sistematizada. O paciente foi acompanhado por nove meses, e os parâmetros analisados foram: peso corporal, escore de condição corporal, escore de massa muscular, escore de condição fecal e níveis de proteína sérica. Após a mudança alimentar, o paciente não apresentou mais ascite e apresentou melhora em todos parâmetros avaliados. Ao desafio alimentar observou-se manifestações clínicas com carne suína e carne de cação, levantando-se a hipótese de que se elas estivessem relacionadas à reação adversa a alimentos. Dessa forma, foi possível formular dois alimentos caseiros, completos e balanceados para cães adultos com ingredientes não relacionados às manifestações clínicas gastroentéricas, e o paciente foi liberado do acompanhamento nutricional.
Palavras-chave: Doenças Inflamatórias Intestinais; Enteropatias; Nutrição; Cães.
Introdução
A saúde do trato gastrointestinal pode ser estimada por ausência/presença de regurgitações e/ou êmese, pelo aumento ou diminuição no peristaltismo intestinal, pelo aumento na fermentação intestinal, resultando em timpanismo, borborigmo e/ou flatulência e, por fim, pelo aspecto do bolo fecal (consistência, coloração, presença/ausência de conteúdo não digerido, de muco ou de sangue) (Silva 2009). O termo doença inflamatória intestinal refere-se a um conjunto de manifestações clínicas caracterizadas por sinais gastrointestinais persistentes, que abrange várias doenças intestinais, cuja semelhança é a infiltração difusa da lâmina própria (WHITE et al., 2017). As causas ainda não são bem compreendidas, mas acredita-se que os mecanismos envolvidos na patogenia estejam associados às reações imunes inadequadas do próprio organismo; à perda de integridade intestinal, às reações de hipersensibilidade da mucosa a diversos agentes, como alimentos ou micro-organismos intestinais, e à predisposição genética (GERMAN; HALL; DAY, 2003). As manifestações clínicas mais comuns são: vômitos crônicos, diarréia e perda de peso, embora as manifestações predominantes dependam dos segmentos intestinais afetadas. Nos casos muito graves, pode-se observar hemorragia ou hipoproteinemia. A literatura não sugere haver predisposição relacionada com idade e sexo; é mais frequente em cães e gatos adultos e parece haver predisposição racial para o desenvolvimento da enteropatia com perda de proteína, sendo as principais raças afetas: Golden Retriver, Daschund, Basenji e Yorkshire Terrier, sendo esses os que têm maior predisposição de desenvolver a doença em sua forma moderada a severa (Marks, 2011; Simmerson et al, 2014). O diagnóstico definitivo da patologia é obtido pela análise histopatológica do segmento afetado, porém outros exames menos invasivos podem auxiliar no diagnóstico presuntivo como a correlação dos exames laboratoriais com exames de imagem como ultrassonografia e endoscopia. Sugere-se realizar: hemograma; bioquímicos (hepático e renal); proteína total; albumina sérica; eletrólitos (Na, Mg, Ca); triglicérides e colesterol.
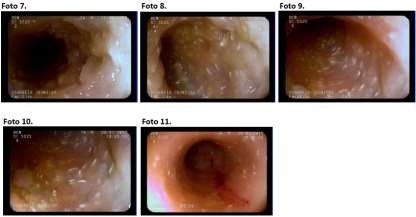
De forma geral, a enteropatia com perda de proteína está tipicamente associada à panhipoproteinemia. A espessura da parede intestinal é um dos parâmetros mais utilizados na identificação ultrassonográfica (KEALY; McALLISTER, 2005) e, hiperemia, edema, pequenas manchas brancas e rugosidade na mucosa são as principais alterações observadas à endoscopia de pacientes com doença inflamatória com perda de proteína (OKANISHI et al., 2014). O principal objetivo do tratamento é minimizar as manifestações clínicas (CRAVEN; WASHABAU, 2019). O tratamento, em cães, baseia-se principalmente no uso de drogas imunossupressoras, enquanto que o manejo nutricional é a peça-chave no tratamento de patologia semelhante em humanos, (CRAVEN; WASHABAU, 2019). Okanishi e colaboradores (2014) observaram que pacientes tratados com a associação de dieta e glicocorticoide toleraram a redução da medicação sem piora clínica, sendo possível a remoção da medicação em 26% dos cães. Por sua vez, Rudnsky e colaboradores (2017), concluíram que a resposta à terapia alimentar é satisfatória, rápida e sem efeitos colaterais.
O alimento deve ser de alta digestibilidade (87-90%), conter alta densidade calórica (superior a 3,5 kcal/g de matéria seca), ser restrito no teor total de gordura (10-15% na matéria seca para doença inflamatória intestinal e inferior a 10% na matéria seca para enteropatia com perda de proteína), fornecer proteína inédita (25-30% na matéria seca) e conter baixo teor de fibra (5% na matéria seca). (DAVENPORT; REMILARD; SIMPSON et al., 1987). Sendo assim, o objetivo do presente trabalho é relatar o caso de um paciente York Shire terrier que apresentava manifestações clínicas de enteropatia inflamatória com perda de proteína cujo manejo terapêutico foi exclusivamente a mudança dietética e comparar as técnicas e as abordagens clínicas aplicadas com a literatura consultada.
Caso clínico
Um cão de raça Yorkshire Terrier, macho, não castrado, de sete anos de idade, com 5,2 kg de peso corporal foi atendido em junho de 2017, com quadro de diarréia, ascite e perda de massa muscular. A diarréia e a ascite eram observadas de forma esporádica desde 2015 e a perda de massa muscular tornou-se evidente no início de 2017. O paciente foi alimentado desde filhote com alimento comercial extrusado completo e balanceado e recebia legumes (brócolis, cenoura e beterraba), frutas (tomate e melancia), carnes (bovino e de frango) e petiscos comerciais próprios para cães como petisco. O paciente estava recebendo um alimento seco extrusado coadjuvante gastroentérico ad libitum e se apresentava com normorexia, normodipsia, não apresentava êmese e nem alterações urinárias, mas apresentava alterações fecais, como urgência para defecar e fezes amareladas, eventualmente com sangue, em escore de condição fecal (ECF) 0/5 (CARCIOFI, 2008). Ao exame físico, foram observados Escore de Condição Corporal (ECC) 3/9 (LAFLAMME, 1997), Escore de massa muscular (EMM) 1/3 (MICHEL et al, 2011), ascite, alopecia em membros posteriores e pelagem sem brilho e quebradiça. No exame de sangue observou-se hipoproteinemia (3,8 g/dl) e hipoalbunemia (0,9 g/dl) e, ao ultrassom abdominal, foi observado espessamento da parede em alças intestinais e ascite. À endoscopia alta, foram notadas placas irregulares em formato de espículas em mucosa, sugestivas de linfagectasia intestinal. O tratamento adotado consistiu, exclusivamente, em modificações dietéticas, através do fornecimento de dois alimentos caseiros completos e balanceados, com teor calórico de 1,13 kcal/g. Foram utilizados ingredientes inéditos ao paciente e os teores de gordura, proteína e de fibra alimentar foram, respectivamente, 19,2 g/1000 Kcal (7,26% na matéria seca), 71 g/1000 Kcal (26,8% na matéria seca) e 18,5 g/1000 Kcal (7% na matéria seca). A necessidade energética diária (NED) do paciente foi calculada pela equação 95 x (PC)0,75 (NRC, 2006). O primeiro alimento foi fornecido durante quatro semanas e o segundo alimento foi fornecido por mais quatro semanas, totalizando oito semanas de exclusão. No 56° dia foi instituído a reexposição alimentar de forma individual por no máximo 15 dias, seguidos de 15 dias de “whash out” com dieta de eliminação, a fim de elucidar a participação de alimentos no quadro inflamatório intestinal. O tutor foi orientado a classificar o alimento como “permitido” ou “proibido”, segundo o surgimento de manifestações clínicas gastroentéricas. No 280° dia o tutor apresentou a lista de alimentos expostos, o que propiciou a formulação de dois alimentos caseiros completos e balanceados de manutenção e liberação do paciente do acompanhamento nutricional, uma vez que ele não mais apresentava as manifestações clínicas e havia recuperado qualidade de vida.
Resultados e discussão
Após a mudança alimentar o paciente não apresentou mais ascite, recuperou escore de condição corporal, massa magra, recuperou qualidade de pelagem (quadro 1) e apresentou melhora no escore de condição fecal a partir do 16º dia (figura 2). A proteína plasmática do paciente reestabeleceu valores normais (6,8 g/dl versus 2,8 g/dl) e, embora não tenha sido mensurado o valor de albumina plasmática ao final do tratamento, afere-se que parâmetro tenha se reestabelecido pela ausência de ascite (albumina inicial 0,9 g/dL). Todos esses resultados indicam que a má absorção resultante da enterite inflamatória crônica foi resolvida.
Os alimentos que foram classificados como “proibidos” foram: carne de cação e lombo suíno. Dentre os diferentes alimentos testados (cação, lombo, peito de frango e carne bovina moída), observa-se que esses não eram os de maior teor de gordura, portanto os resultados sugerem que o paciente apresentava enterite por reação adversa ao alimento. Essa observação concorda com a literatura disponível, uma vez que a reação adversa ao alimento tem sido considerada a causa mais comum de enterite inflamatória (VOLKMANN et al., 2017). Magalhães (2008) sugere que a dieta constitui uma enorme fonte de antígenos para o desenvolvimento da doença e que o papel do alimento na patogenia é suportado pela observação da remissão dos sintomas quando o alimento é substituído por uma dieta de eliminação (com fontes inéditas de proteína e/ou proteína hidrolisada). Embora o principal estímulo antigênico seja a proteína, a utilização de alimento com baixo teor de gordura e escolha de fontes de nutrientes de alta digestibilidade se justifica tanto pela tentativa de amenizar as injúrias ao trato gastrointestinal do paciente quanto pela redução da carga linfática no intestino para transporte de ácidos graxos e, consequentemente, para reduzir a perda de proteína pelos enterócitos. Craven e Washabau (2019) sugerem, que a distribuição calórica do alimento para cães deva ser de 55% a 60% de carboidrato; 10% a 15% de gordura total e 25% a 30% de proteína de alta digestibilidade. Os cardápios de exclusão formulados para esse paciente apresentam distribuições semelhantes (26% a 30% das calorias provenientes de proteína; 14,6% a 15,8% das calorias provenientes de gordura e 54,7% a 58% das calorias provenientes de carboidrato). A prescrição de alimento caseiro se justifica pela necessidade de fornecer um alimento de exclusão com baixo teor de gordura, alta digestibilidade e alta palatabilidade. Houpt, Hintz e Shepherd (1978) sugerem que cães têm preferência por alimentos úmidos a secos e preferem carne fresca a alimentos à base de milho e de farelo de soja.

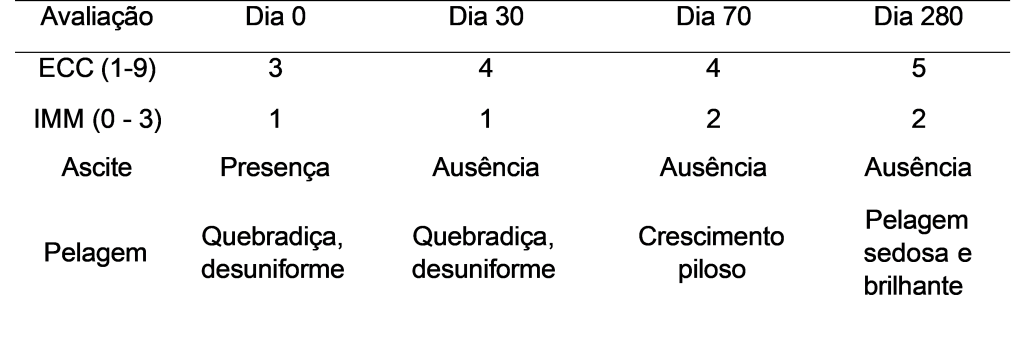
Conclusão
Embora as causas da doença inflamatória intestinal ainda não sejam totalmente elucidadas, a reação adversa ao alimento tem se mostrado um fator importante na patogenia da doença, por desencadear uma resposta inflamatória local bastante intensa. A gravidade da doença e a piora no prognóstico dependem do segmento intestinal afetado e das manifestações clínicas que o paciente apresenta. Dentre os fatores intrínsecos ao alimento, a literatura sugere que a proteína dietética seja reconhecida pelo sistema imunológico como um antígeno alimentar. Portanto, o diagnóstico consiste em duas etapas, exclusão alimentar por oito semanas seguida de desafio alimentar. O alimento de exclusão deve ser de fácil digestão, conter alta densidade nutricional, teor de proteína mínimo para atender à necessidade protéica do paciente e teor de gordura adequado à gravidade da doença, sendo que em patologias com perda de proteína deve-se fornecer teor total de gordura inferior a 10%, a fim de reduzir a espoliação protéica. Por meio dessas adequações nutricionais, foi possível restituir o status nutricional e a qualidade de vida ao paciente, bem como o adequado convívio com seus tutores.
Referências bibliográficas
CARCIOFI, A.C. et al. Effects of six carbohydrate sources on dog diet digestibility and post-prandial glucose and insulin response. Journal of Animal Physiology and Animal Nutrition, v.92, p.326-336, 2008.
CRAVEN, M. D.; WASHABAU, R. J. Comparative pathophysiology and management of protein-losing enteropathy. Journal of Veterinary Internal Medicine. [S.l.]: Blackwell Publishing Inc., p. 1-20, mar. 2019
DAVENPORT, D.J.; REMILARD, R.L.; SIMPSON, K.W. et al. Gastrointestinal and exocrine pancreatic disease. In: HAND, M. S.; THATCHER, C. D.; REMILLARD, R.L.; ROUDEBUSH, P. (eds.). Small Animal Clinical Nutrition. 4. ed. Marceline: Mark Morris Institute; 2000. p. 725-810
GERMAN, A. J.; HALL, E. J.; DAY, M. J. Chronic intestinal inflammation and intestinal disease in dogs.US National Library of Medicine, Rockville Pike, v. 17, p. 8-20, jan. 2003.
HOUPT, K. A.; HINTZ, H. F.; SHEPHERD, P. The role of olfaction in canine food preferences. Chemical Senses, v. 3, n. 3, p. 281-290, set. 1978.
KEALY, J. K.; McALLISTER, H. The abdomen: the small intestine. In . Diagnostic radiology & ultrasound of the dog and cat. 4. ed. Philadelphia: Saunders, 2005. p. 77-92
LAFLAMME, D. Development and validation of a body condition score system for dogs. Canine Practice, v. 22, p. 10-15, 1997.
MAGALHÃES, T. M. L. P. Enterite linfoplasmocítica canina. 134f. Dissertação (Mestrado Integrado em Medicina Veterinária) – Universidade Técnica de Lisboa, Lisboa, 2008.
MARKS, S. L. How I diagnose and manage protein-losing enteropathies in dogs In: North American Veterinary Community conference, 25, 2011, Orlando. Anais… Gainesville: North American Veterinary Community, 2011.
MICHEL, K.; ANDERSON, W.; CUPP, C.; LAFLAMME, D. Correlation of a feline mass score with body composition determined by dual-energy X-ray absorptionmetry. British Journal of Nutrition, v. 106, p. S57-S59, 2011.
NUTRIENT REQUIREMENTS OF DOGS AND CATS. National Research Council. Washington: National Academies Press, 2006.
OKANISHI, H. et al. The clinical efficacy of dietary fat restriction in treatment of dogs with intestinal lymphangiectasia. Journal of Veterinary Internal Medicine, v. 28, n. 3, p. 809- 817, 2014.
RUDINSKY, A. J. et al. Dietary management of presumptive protein-losing enteropathy in Yorkshire terriers. Journal of Small Animal Practice, v. 58, n. 2, p. 103-108, fev. 2017.
SILVA, N. E. O. F.Nutrição do intestino, imunidade intestinal e resistência a parasitas do intestino em cães.174f. Dissertação (Mestrado Integrado em Medicina Veterinária) – Universidade Técnica de Lisboa, Lisboa, 2009.
SIMMERSON, S. M. et al. Clinical features, intestinal histopathology, and outcome in protein-losing enteropathy in yorkshire terrier dogs. Journal of Veterinary Internal Medicine, v. 28, n. 2, p. 331-337, mar. 2014.
VOLKMANN, M. et al. Chronic Diarrhea in Dogs: Retrospective Study in 136 Cases. Journal of Veterinary Internal Medicine, v. 31, n. 4, p. 1043-1055, jul. 2017.
WASHABAU, R. J.; DAY, M. J.; WILLARD, M. D.; HALL, E. J.; JERGENS, A. E.;
MANSELL, J.; MINAMI, T. et al. Endoscopic, biopsy, and histopathologic guidelines for the evaluation of gastrointestinal inflammation in companion animals. Journal of Veterinary Internal Medicine, v. 24, n.1, p. 10-26, jan.-fev. 2010.
WHITE, R. et al. Randomized, controlled trial evaluating the effect of multi-strain probiotic on the mucosal microbiota in canine idiopathic inflammatory bowel disease. Gut Microbes, v. 8, n. 5, p. 451-466, set. 2017.





